摘要:13.某温度下.将a gMgSO4·7H2O溶于b g水得到饱和溶液(密度为d g·cm-3).下列说法正确的是( ) A.该温度下.MgSO4的溶解度为12000a/ g B.该温度下.MgSO4的饱和溶液中.MgSO4的质量分数为a/(a+b) C.该温度下.MgSO4的饱和溶液中.c(Mg2+)=ad/[246(a+b)]mol·L-1 D.向足量该饱和溶液中加入1.2g MgSO4.将析出2.46 g MgSO4·7H2O晶体
网址:http://m.1010jiajiao.com/timu3_id_37223[举报]
 能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1
反应II:CO(g)+2H2(g)?CH3OH(g)△H2
下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
<
<
0(填“>”、“<”或“=”),②若容器容积不变,下列措施可增加甲醇产率的是
BE
BE
,A.升高温度 B.将CH3OH(g)从体系中分离 C.使用合适的催化剂
D.充入He,使体系总压强增大 E.按原比例再充入 CO和 H2
③某温度下,将2mol CO和6mol H2充入2L的恒容密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol?L-1,则CO的转化率为
80%
80%
,此时的温度为250°C
250°C
(从上表中选择);④恒温下,1mol CO和nmol H2在一个容积可变的密闭容器中反应达到平衡后,生成a molCH3OH.若起始时放入3molCO+3nmolH2,则达平衡时生成CH3OH
3a
3a
mol.(2)某实验小组依据甲醇燃烧的反应原理,设计如图所示的原电池装置.
①该电池工作时,OH-向
负
负
极移动(填“正”或“负”),②该电池正极的电极反应式为
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.在10L的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)?CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
请回答:
(1)该反应为
(2)该反应的化学平衡常数表达式为K=
.
(3)能说明该反应达到化学平衡状态的是
a.υ正(CO2)=υ正(H2) b.υ逆(CO)=υ逆(H2O)
c.υ逆(H2)=υ逆(H2O) d.υ正(H2)=υ逆(H2)
(4)某温度下,将CO2和H2各0.10mol充入该容器中,达到平衡后,测得 c(CO)=0.0080mol/L,则CO2的转化率为
(5)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为
查看习题详情和答案>>
CO2(g)+H2(g)?CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为
吸热
吸热
(填“吸热”或“放热”)反应.(2)该反应的化学平衡常数表达式为K=
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
(3)能说明该反应达到化学平衡状态的是
d
d
(填字母).a.υ正(CO2)=υ正(H2) b.υ逆(CO)=υ逆(H2O)
c.υ逆(H2)=υ逆(H2O) d.υ正(H2)=υ逆(H2)
(4)某温度下,将CO2和H2各0.10mol充入该容器中,达到平衡后,测得 c(CO)=0.0080mol/L,则CO2的转化率为
80%
80%
.(5)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为
830
830
℃.在10L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
请回答:
(1)该反应为
(2)该反应的化学平衡常数表达式为K=
.
(3)能说明该反应达到化学平衡状态的是
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,将CO2和H2各0.10mol充入该容器中,达到平衡后,测得 c(CO)=0.0080mol/L,则CO2的转化率为
(5)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为
查看习题详情和答案>>
其化学平衡常数K和温度t的关系如下表:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为
吸热
吸热
(填“吸热”或“放热”)反应.(2)该反应的化学平衡常数表达式为K=
| C(CO)C(H2O) |
| C(H2)C(CO2) |
| C(CO)C(H2O) |
| C(H2)C(CO2) |
(3)能说明该反应达到化学平衡状态的是
b
b
(填字母).a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,将CO2和H2各0.10mol充入该容器中,达到平衡后,测得 c(CO)=0.0080mol/L,则CO2的转化率为
80%
80%
.(5)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为
830
830
℃.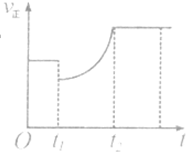 某温度下,将等物质的量的A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(s).当反应进行一段时间后,测得A减少了nmol,B减少了
某温度下,将等物质的量的A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(s).当反应进行一段时间后,测得A减少了nmol,B减少了| n |
| 2 |
| 3n |
| 2 |
| A、达到化学平衡时A的消耗速率与C的消耗速率相等 | ||
B、保持温度不变,再向容器中充入n molA和
| ||
| C、上图表示该反应的正反应速率随时间的变化情况,t1时刻可能是减少了A的浓度,增加了C的浓度 | ||
| D、保持温度不变,再向容器中充入nmolA和nmolB,A、B的转化率均不变 |
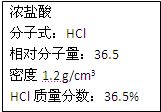 右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:(1)该浓盐酸中HCl的物质的量浓度为
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为 0.30mol/L稀盐酸.
①该学生需要量取
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,轻轻摇动容量瓶
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶的玻璃塞盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
③在配制过程中,下列操作会使所配制的稀盐酸物质的量浓度偏高的是
A.用量筒量取浓盐酸时俯视观察凹液面
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻度线
D.在配置前用已知浓度的稀盐酸润洗容量瓶
(4)现将200mL 0.30mol/L的盐酸与50mL 0.80mol/L CaCl2溶液混合(体积变化忽略不计),所得溶液中Cl-的物质的量浓度是
(5)在标准状况下,将
(6)某温度下,将Cl2通入NaOH溶液中,反应得到NaClO、NaClO3的混合溶液,经测定ClO-与ClO3-的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯原子与被氧化的氯原子的物质的量之比为