摘要:已知二氧化碳气体通入氢氧化钠溶液中.可能发生下列两个反应: ⑴CO2+2NaOH=Na2CO3+H2O ⑵CO2+Na2CO3+H2O=2NaHCO3 现将一定量的二氧化碳气体通往500ml的某氢氧化钠溶液中.充分反应后. 将溶液在低温下蒸发. 得到不含结晶水的白色固体A . 取三份质量不同的A 样品分别与50ml相同深度的盐酸反应.得到的气体在标准状况下的与固体A 的质量关系如下表所示: ⑴通过计算确认第几组A在反应后有剩余? ⑵通过计算确认A 的成分及各成分的质量分数? (CO2在标准状况下的密度是
网址:http://m.1010jiajiao.com/timu3_id_372[举报]
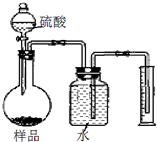 Ⅰ.氢氧化钠固体中可能混有碳酸钠,甲、乙、丙三位同学分别取样溶于水进行检验.
Ⅰ.氢氧化钠固体中可能混有碳酸钠,甲、乙、丙三位同学分别取样溶于水进行检验.
①甲用稀盐酸检验.滴入稀盐酸,有气泡生成,写出涉及该现象的反应化学方程式________.
②乙用澄清的石灰水检验.若混有碳酸钠,可观察到的现象是________.
③丙用紫色石蕊试液检验.老师认为该方法不妥,理由是________.
Ⅱ.甲、乙、丙三位同学继续探究氢氧化钠样品中氢氧化钠的质量分数
①甲、乙取10g样品溶于水,滴加足量的BaCl2溶液至沉淀完全,过滤、洗涤、干燥、称得固体质量为1.97g.
请计算:样品中碳酸钠的质量为________g,样品中氢氧化钠的质量分数为________.
(反应的化学方程式为Na2CO3+BaCl2═BaCO3↓+2NaCl,已知Na2CO3 和BaCO3的相对分子质量分别为106、197)
②丙设计了如图所示方案来测定样品中氢氧化钠的质量分数.通过测量排出水的体积,根据二氧化碳的密度可换算为二氧化碳的质量,得出样品中氢氧化钠的质量分数为95%.
【反思与评价】:丙同学得到的结果与甲、乙不同.通过交流认为丙的设计方案存在缺陷,可能的原因是________,你的改进方法是________.
查看习题详情和答案>>
碳和碳的氧化物是生活中常见的物质,也是初中化学学习的重要内容.
(1)如图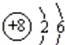 是,下列说法不正确的是 .
是,下列说法不正确的是 .
| A.氧原子的质子数为8 |
| B.氧原子在化学反应中易失去电子 |
| C.氧是地壳中含量最多的元素 |
| D.氧原子与氧离子的化学性质不同 |
(3)实验室里,几位同学在制取二氧化碳.
①小刚同学用浓度为15%的稀盐酸与块状大理石反应制取二氧化碳,小明同学用浓度为8%的稀盐酸与块状大理石反应制取二氧化碳,发现小刚同学收集到相同体积二氧化碳的速度比小同学快,由此你能得到的结论是 .
②小平同学用加热碳酸氢钠的方法也能制得CO2,已知碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,请写出该反应的化学方程式 .
(4)小明将氢氧化钠溶液与氯化钡溶液混合,发现无明显现象.一段时间后,他再次取敞口放置的上述两种溶液进行混合,结果出现了白色沉淀,请你用化学方程式解释可能的原因.(提示:BaCO3是白色、难溶于水)
(5)一氧化碳和氢气虽然具有相似的化学性质,如还原性、可燃性等,但一氧化碳却不是新能源的发展方向,从安全和环保的角度来看,这其中的重要原因是什么?
(6)称取5g石灰石(杂质不参加反应)放入烧杯中,向其中加入足量稀盐酸,将反应生成的气体全部通入有足量澄清石灰水的烧杯中(气体全部被吸收),反应结束后称量烧杯中物质的质量增加了1.76g.试计算石灰石中含有杂质的质量分数. 查看习题详情和答案>>
碱石灰是氧化钙和氢氧化钠的固体混合物,是实验室常用的干燥剂.某研究性
学习小组对在空气中长期露置已变质的碱石灰样品进行如下探究.
Ⅰ.定性探究
[提出问题]碱石灰样品中可能含有哪些物质?
[猜 想]猜想一:可能含有Na2C03,作出此猜想的依据是______(用化学方程式表示).
猜想二:可能含有Ca(OH)2,作出此猜想的依据是______(用简洁的文字表述).
[设计实验]
[提示]Na2C03和 Ca(OH)2溶于水均无明显热量变化.
[交流与讨论]
(1)小鹏同学提出:“步骤①中形成浊液,说明样品中含有碳酸钙”,你认为他的观点______(填“正确”或“不正确”).
(2)小虎同学认为本实验设计中,碱石灰样品中是否有CaC03是无法证明的.于是他和小兰,小娟认真探究,设计出了判断是否有CaC03的实验方案:他(她)们取几大块已变质的碱石灰样品,从表面刮取一定量的固体,进行______(操作方法),再将产生的气体通入澄清的石灰水,变浑浊,证明样品中有碳酸钙(提示:碳酸钠高温不分解).
Ⅱ.定量探究
[提出问题]样品中碳酸钠的质量分数的最大值是多少呢?小娟同学设计了以下方案:

则样品中Na2C03的质量分数的最大值是多少?(写出计算过程)
[交流与反思]
小兰同学认为小娟同学得到的计算结果不准确.因为稀盐酸有挥发性,可能导致测得的碳酸钠的质量分数偏大.由于挥发量不大,可以忽略不计.
查看习题详情和答案>>
学习小组对在空气中长期露置已变质的碱石灰样品进行如下探究.
Ⅰ.定性探究
[提出问题]碱石灰样品中可能含有哪些物质?
[猜 想]猜想一:可能含有Na2C03,作出此猜想的依据是______(用化学方程式表示).
猜想二:可能含有Ca(OH)2,作出此猜想的依据是______(用简洁的文字表述).
[设计实验]
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量样品置于试管中,加足量的水溶解,观察并用手触摸试管外壁 | 形成浊液 试管外壁发热 | 则样品中CaO 和______ 至少有一种 |
| ②将①的浊液过滤,向所得的滤液中逐滴加入氯化钙溶液至过量 | 产生白色沉淀 | 样品中含有的物质是______ |
| ③将②的浊液过滤,向所得的滤液中滴加几滴酚酞溶液 | 溶液______ | 由步骤①可知:最后滤液一定显碱性, 因此无法检验样品中的Ca(OH)2 |
[交流与讨论]
(1)小鹏同学提出:“步骤①中形成浊液,说明样品中含有碳酸钙”,你认为他的观点______(填“正确”或“不正确”).
(2)小虎同学认为本实验设计中,碱石灰样品中是否有CaC03是无法证明的.于是他和小兰,小娟认真探究,设计出了判断是否有CaC03的实验方案:他(她)们取几大块已变质的碱石灰样品,从表面刮取一定量的固体,进行______(操作方法),再将产生的气体通入澄清的石灰水,变浑浊,证明样品中有碳酸钙(提示:碳酸钠高温不分解).
Ⅱ.定量探究
[提出问题]样品中碳酸钠的质量分数的最大值是多少呢?小娟同学设计了以下方案:

则样品中Na2C03的质量分数的最大值是多少?(写出计算过程)
[交流与反思]
小兰同学认为小娟同学得到的计算结果不准确.因为稀盐酸有挥发性,可能导致测得的碳酸钠的质量分数偏大.由于挥发量不大,可以忽略不计.
查看习题详情和答案>>
碳和碳的氧化物是生活中常见的物质,也是初中化学学习的重要内容.
(1)如图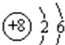 是,下列说法不正确的是 .
是,下列说法不正确的是 .
(2)一氧化碳与二氧化碳性质不同的原因是什么?
(3)实验室里,几位同学在制取二氧化碳.
①小刚同学用浓度为15%的稀盐酸与块状大理石反应制取二氧化碳,小明同学用浓度为8%的稀盐酸与块状大理石反应制取二氧化碳,发现小刚同学收集到相同体积二氧化碳的速度比小同学快,由此你能得到的结论是 .
②小平同学用加热碳酸氢钠的方法也能制得CO2,已知碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,请写出该反应的化学方程式 .
(4)小明将氢氧化钠溶液与氯化钡溶液混合,发现无明显现象.一段时间后,他再次取敞口放置的上述两种溶液进行混合,结果出现了白色沉淀,请你用化学方程式解释可能的原因.(提示:BaCO3是白色、难溶于水)
(5)一氧化碳和氢气虽然具有相似的化学性质,如还原性、可燃性等,但一氧化碳却不是新能源的发展方向,从安全和环保的角度来看,这其中的重要原因是什么?
(6)称取5g石灰石(杂质不参加反应)放入烧杯中,向其中加入足量稀盐酸,将反应生成的气体全部通入有足量澄清石灰水的烧杯中(气体全部被吸收),反应结束后称量烧杯中物质的质量增加了1.76g.试计算石灰石中含有杂质的质量分数.
(1)如图
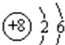 是,下列说法不正确的是 .
是,下列说法不正确的是 .| A.氧原子的质子数为8 |
| B.氧原子在化学反应中易失去电子 |
| C.氧是地壳中含量最多的元素 |
| D.氧原子与氧离子的化学性质不同 |
(3)实验室里,几位同学在制取二氧化碳.
①小刚同学用浓度为15%的稀盐酸与块状大理石反应制取二氧化碳,小明同学用浓度为8%的稀盐酸与块状大理石反应制取二氧化碳,发现小刚同学收集到相同体积二氧化碳的速度比小同学快,由此你能得到的结论是 .
②小平同学用加热碳酸氢钠的方法也能制得CO2,已知碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,请写出该反应的化学方程式 .
(4)小明将氢氧化钠溶液与氯化钡溶液混合,发现无明显现象.一段时间后,他再次取敞口放置的上述两种溶液进行混合,结果出现了白色沉淀,请你用化学方程式解释可能的原因.(提示:BaCO3是白色、难溶于水)
(5)一氧化碳和氢气虽然具有相似的化学性质,如还原性、可燃性等,但一氧化碳却不是新能源的发展方向,从安全和环保的角度来看,这其中的重要原因是什么?
(6)称取5g石灰石(杂质不参加反应)放入烧杯中,向其中加入足量稀盐酸,将反应生成的气体全部通入有足量澄清石灰水的烧杯中(气体全部被吸收),反应结束后称量烧杯中物质的质量增加了1.76g.试计算石灰石中含有杂质的质量分数.