题目内容
 Ⅰ.氢氧化钠固体中可能混有碳酸钠,甲、乙、丙三位同学分别取样溶于水进行检验.
Ⅰ.氢氧化钠固体中可能混有碳酸钠,甲、乙、丙三位同学分别取样溶于水进行检验.
①甲用稀盐酸检验.滴入稀盐酸,有气泡生成,写出涉及该现象的反应化学方程式________.
②乙用澄清的石灰水检验.若混有碳酸钠,可观察到的现象是________.
③丙用紫色石蕊试液检验.老师认为该方法不妥,理由是________.
Ⅱ.甲、乙、丙三位同学继续探究氢氧化钠样品中氢氧化钠的质量分数
①甲、乙取10g样品溶于水,滴加足量的BaCl2溶液至沉淀完全,过滤、洗涤、干燥、称得固体质量为1.97g.
请计算:样品中碳酸钠的质量为________g,样品中氢氧化钠的质量分数为________.
(反应的化学方程式为Na2CO3+BaCl2═BaCO3↓+2NaCl,已知Na2CO3 和BaCO3的相对分子质量分别为106、197)
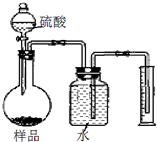
②丙设计了如图所示方案来测定样品中氢氧化钠的质量分数.通过测量排出水的体积,根据二氧化碳的密度可换算为二氧化碳的质量,得出样品中氢氧化钠的质量分数为95%.
【反思与评价】:丙同学得到的结果与甲、乙不同.通过交流认为丙的设计方案存在缺陷,可能的原因是________,你的改进方法是________.
Na2CO3+2HCl=2NaCl+CO2↑+H2O 有白色浑浊出现 氢氧化钠溶液和碳酸钠溶液均呈现碱性,都可以使紫色石蕊试液变蓝色 1.06 89.4% 生成的二氧化碳可溶于水,从而测得的二氧化碳的体积变小 在广口瓶内水的上方加一层植物油(或在广口瓶进气导管末端系一个气球等合理答案)
分析:Ⅰ、①据碳酸钠和盐酸反应原理书写方程式;
②碳酸钠会与澄清石灰水的主要成分氢氧化钙反应生成碳酸钙白色沉淀,据此分析解答;
③氢氧化钠溶液和碳酸钠溶液均呈现碱性,都可以使紫色石蕊试液变蓝色,故用该法无法判断;
Ⅱ、①碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,据反应方程式及生成的碳酸钡的质量可计算出样品中碳酸钠的质量,进而计算出氢氧化钠的质量分数;
②丙同学是用排水法收集二氧化碳,通过其质量计算氢氧化钠的质量分数,由于二氧化碳能溶于水,会使测量的二氧化碳体积变小,则质量减小,碳酸钠的质量减少,从而造成氢氧化钠的质量分数变大;可以在广口瓶内水的上方加一层植物油,防止二氧化碳溶于水,或在广口瓶进气导管末端系一个气球.
解答:Ⅰ、①碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,方程式是Na2CO3+2HCl=2NaCl+CO2↑+H2O;
②碳酸钠会与澄清石灰水的主要成分氢氧化钙反应生成碳酸钙白色沉淀,所以若混有碳酸钠,可观察到有白色浑浊出现;
③氢氧化钠溶液和碳酸钠溶液均呈现碱性,都可以使紫色石蕊试液变蓝色,故用该法无法判断;
Ⅱ、①设样品中含有碳酸钠的质量为X
BaCl2+Na2CO3=2NaCl+BaCO3↓
106 197
x 1.97g
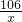 =
=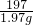
x=1.06g
则原试剂中NaOH的质量分数为: ×100%=89.4%
×100%=89.4%
②丙同学是用排水法收集二氧化碳,通过其质量计算氢氧化钠的质量分数,由于二氧化碳会溶于水中,使测量的二氧化碳体积变小,则质量减小,碳酸钠的质量减少,从而造成氢氧化钠的质量分数变大;可以在广口瓶内水的上方加一层植物油,防止二氧化碳溶于水,或在广口瓶进气导管末端系一个气球;
故答案为:Ⅰ、①Na2CO3+2HCl=2NaCl+CO2↑+H2O;
②有白色浑浊出现;
③氢氧化钠溶液和碳酸钠溶液均呈现碱性,都可以使紫色石蕊试液变蓝色;
Ⅱ、①1.06;89.4%;
②生成的二氧化碳可溶于水,从而测得的二氧化碳的体积变小;在广口瓶内水的上方加一层植物油(或在广口瓶进气导管末端系一个气球等合理答案).
点评:熟练掌握氢氧化钠、碳酸钠的化学性质,知道氢氧化钠的变质的原因并能够选择合适的方法进行检验,了解方程式计算的方法,并能据物质的性质正确分析解答相关问题,要结合所学知识细心分析解答.
分析:Ⅰ、①据碳酸钠和盐酸反应原理书写方程式;
②碳酸钠会与澄清石灰水的主要成分氢氧化钙反应生成碳酸钙白色沉淀,据此分析解答;
③氢氧化钠溶液和碳酸钠溶液均呈现碱性,都可以使紫色石蕊试液变蓝色,故用该法无法判断;
Ⅱ、①碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,据反应方程式及生成的碳酸钡的质量可计算出样品中碳酸钠的质量,进而计算出氢氧化钠的质量分数;
②丙同学是用排水法收集二氧化碳,通过其质量计算氢氧化钠的质量分数,由于二氧化碳能溶于水,会使测量的二氧化碳体积变小,则质量减小,碳酸钠的质量减少,从而造成氢氧化钠的质量分数变大;可以在广口瓶内水的上方加一层植物油,防止二氧化碳溶于水,或在广口瓶进气导管末端系一个气球.
解答:Ⅰ、①碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,方程式是Na2CO3+2HCl=2NaCl+CO2↑+H2O;
②碳酸钠会与澄清石灰水的主要成分氢氧化钙反应生成碳酸钙白色沉淀,所以若混有碳酸钠,可观察到有白色浑浊出现;
③氢氧化钠溶液和碳酸钠溶液均呈现碱性,都可以使紫色石蕊试液变蓝色,故用该法无法判断;
Ⅱ、①设样品中含有碳酸钠的质量为X
BaCl2+Na2CO3=2NaCl+BaCO3↓
106 197
x 1.97g
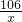 =
=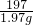
x=1.06g
则原试剂中NaOH的质量分数为:
 ×100%=89.4%
×100%=89.4%②丙同学是用排水法收集二氧化碳,通过其质量计算氢氧化钠的质量分数,由于二氧化碳会溶于水中,使测量的二氧化碳体积变小,则质量减小,碳酸钠的质量减少,从而造成氢氧化钠的质量分数变大;可以在广口瓶内水的上方加一层植物油,防止二氧化碳溶于水,或在广口瓶进气导管末端系一个气球;
故答案为:Ⅰ、①Na2CO3+2HCl=2NaCl+CO2↑+H2O;
②有白色浑浊出现;
③氢氧化钠溶液和碳酸钠溶液均呈现碱性,都可以使紫色石蕊试液变蓝色;
Ⅱ、①1.06;89.4%;
②生成的二氧化碳可溶于水,从而测得的二氧化碳的体积变小;在广口瓶内水的上方加一层植物油(或在广口瓶进气导管末端系一个气球等合理答案).
点评:熟练掌握氢氧化钠、碳酸钠的化学性质,知道氢氧化钠的变质的原因并能够选择合适的方法进行检验,了解方程式计算的方法,并能据物质的性质正确分析解答相关问题,要结合所学知识细心分析解答.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案
相关题目
 如图所示,充满空气的集气瓶塞上同时插有一支盛有有色溶液U形管和一支盛有水的小试管.回答以下问题:
如图所示,充满空气的集气瓶塞上同时插有一支盛有有色溶液U形管和一支盛有水的小试管.回答以下问题: (2011?宁德质检)Ⅰ.氢氧化钠固体中可能混有碳酸钠,甲、乙、丙三位同学分别取样溶于水进行检验.
(2011?宁德质检)Ⅰ.氢氧化钠固体中可能混有碳酸钠,甲、乙、丙三位同学分别取样溶于水进行检验.