摘要:(二)画出实验用的电路图. 普客汽车 快客汽车 火车 里程/km 116 140 118 班次 7:20 8:00 8:20 8:30 8:33 10:30 9:00 14:30 9:30 15:00 -- -- 23.一位旅客可用三种方法从自贡到泸州:第一种是乘普客汽车经邓关.赵化到达.第二种是乘快客汽车经内江.隆昌的高速公路到达.第三种是乘火车到达.右面是三种车的发车时刻及里程表.已知普客汽车全程平均速度大小为60km/h.快客汽车全程平均速度大小为100km/h.两车途中均不停站.火车在中途需停靠内江站和隆昌站各5min.设火车进站和出站都做匀变速直线运动.加速度大小是2400km/h2.途中匀速行驶.速度为120km/h. 若现在时刻是上午8点05分.这位旅客想早点赶到泸州.请你通过计算说明他该选择乘座什么车? 24.对天体而言.若取物体离天体无穷远引力势能为零.则物体由于受天体引力作用而具有的重力势能可用计算.其中G为万有引力恒量.m为物体质量.M为天体质量.R为物体到天体中心的距离.已知地球半径R0=6.4×106m.地球表面重力加速度g0=9.8m/s2.月球绕地球公转的轨道半径r=60R0.现要发射一颗与月球具有相同轨道的地球卫星.其发射速度应为多少?(取两位有效数字.忽略空气阻力及其他天体对卫星的作用) 25.空间存在着以x=0平面为分界面的两个匀强磁场.左右两边磁场的磁感应强度分别为B1和B2.且B1:B2=4:3.方向如图所示.现在原点O处一静止的中性原子.突然分裂成两个带电粒子a和b.已知a带正电荷.分裂时初速度方向为沿x轴正方向.若a粒子在第四次经过y轴时.恰好与b粒子第一次相遇.求: (1)a粒子在磁场B1中作圆周运动的半径与b粒子在磁场B2中圆周运动的半径之比. (2)a粒子和b粒子的质量之比. 26.A-L所代表的各物质是中学化学里常见的物质.已知B.J是单质.A是化合物.E的溶液跟苯酚溶液混合.溶液呈紫色.A-L各物质之间相互反应转化关系如下图所示.请回答: B在A的浓溶液中反应的条件是 .常温下B在A的浓溶液中难以溶解的原因是 . 写出下列化学方程式: F→G+A . G→F . E→I的离子方程式 . L转化成I的现象是 , 其化学方程式为 . 27.某实验小组拟用50mL NaOH溶液吸收CO2气体.制备Na2CO3溶液.为了防止通入的CO2气体过量生成NaHCO3.设计了如下实验步骤: ①用25mL NaOH溶液吸收CO2气体.至CO2气体不再溶解, ②小火煮沸溶液1 min-2min, ③在得到的溶液中加入另一半NaOH溶液.使其充分混合. 此方案能制得较纯净的Na2CO3(第一步的实验装置如图所示). 将块状大理石加入试管中的正确方法是 . 写出①.③两步的化学反应程式 . 装置B中盛放的试剂是 .作用是 . 有人认为将实验步骤②.③的顺序对调.即先混合再煮沸.更合理.你认为对吗? .理由 . 此实验中的装置A还可以作为下列 气体的发生装置 ①NH3 ②H2 ③C2H4 实验室中吸收尾气的方法很多.下列装置中可以用来吸收氨气的是 . 28.烯烃通过臭氧化并经锌和水处理得到醛或酮.例如: 已知丙醛的燃烧热为1815kJ/mol.试写出丙醛燃烧的热化学方程式: 上述反应可用来推断烯烃的结构.一种链状单烯烃A通过臭氧化并经锌和水处理得到B和C.化合物B含碳69.8%.含氢11.6%.B无银镜反应.催化加氢生成D.D在浓硫酸存在下加热.可得到能使溴水褪色且只有一种结构的物质E.反应图示如下: 回答下列问题: ①B的相对分子质量是 ,C→F的反应类型为 ,D中含有官能团的名称 . ②D+F→G的化学方程式是: . ③A的结构简式为 . ④化合物A的某种同分异构体通过臭氧氧化并经锌和水处理只得到一种产物.符合该条件的异构体的结构简式有 种. 29.某复盐的组成可表示为:xA2R·yBR·zH2O.R为-2价含氧酸根.为了确定该盐的组成.进行如下实验: ①准确称取4.02g样品加热到失去全部结晶水.冷却后称量.质量为2.94g. ②将剩余固体溶于适量水.滴加盐酸.无现象.再滴加足量Ba(NO3)2溶液.产生白色沉淀.过滤.将沉淀烘干.称质量为4.66g. ③向上述溶液中加入过量NaOH溶液.产生白色沉淀.过滤.将沉淀烘干.称质量为0.58g.再将固体高温灼烧后冷却.称得剩余固体质量是0.40g. 请通过计算回答下列问题: 确定R的化学式.R的化学式为 . B元素的名称是 . 求x.y.z的值:x= .y= .z= . A元素的名称是 . 该复盐的化学式为 . 30. 已知豌豆中存在矮生型突变体.它们表现为节间缩短的性状.成熟时植株高度只能达到正常植株20%-25%.但施用外源赤霉素能使矮生型突变体恢复到正常的野生型的高度.为了验证这一结论.请你根据以下实验材料和用具.写出实验步骤.实验结果和实验结论.并回答有关问题. 实验材料和用具: 生长状况相似的矮生型突变豌豆幼苗和生长状况相似的正常野生型豌豆幼苗若干株.蒸馏水.5×10-10mol·L-1赤霉素溶液.直尺等. 实验步骤: (1) . (2) . (3) . 实验结果: . 实验结论: . 有人认为用外源生长素代替外源赤霉素也能达到同样的效果.请你作出判断并说出相应的理由: . 31. 回答下列两小题 (1)鸡冠的形状由两对基因控制.这两对基因按自由组合定律遗传.与性别无关.据下表回答问题: 项目 基因组合 A B 型 A bb型 aaB 型 aabb型 鸡冠形状 核桃状 玫瑰状 豌豆状 单片状 杂交 组合 甲:核桃状×单片状→F1:核桃状.玫瑰状.豌豆状.单片状 乙:玫瑰状×玫瑰状→F1:玫瑰状.单片状 丙:豌豆状×玫瑰状→F1:全是核桃状 ①甲组杂交方式在遗传学上称为 ,甲组杂交F1代四种表现型比例是 . ②让乙组后代F1中玫瑰状鸡冠的与另一纯合豌豆状鸡冠的杂交.杂交后代表现型及比例在理论上是 . ③让丙组F1中的雌雄个体交配.后代表现为玫瑰状鸡冠的有120只.那表现为豌豆状的杂合子理论上有 只. ④基因型为AaBb与Aabb的个体杂交.后代中纯合子比例占 . (2)20世纪初.科学家弗莱明在实验中偶然发现.被其他细菌污染的培养皿中.青霉菌菌落周围一圈区域内其他细菌不能生存.后来经提纯分析.发现了青霉素. ①请在下图中找出能表示青霉菌与细菌之间关系的坐标曲线.并说明理由. 你选择的曲线图是 .理由是 . ②在生态系统中.像青霉菌这样的生物有什么重要意义? . ③野生青霉菌的青霉素产量较低.人们对青霉菌进行X射线.紫外线照射等技术处理.培育出了能遗传的高产菌株.但该育种方法也有缺点.即 . ④青霉菌对大粒肠杆菌效力不高.是因为大肠杆菌的某种质粒中含有青霉素抗性基因.假如用该质粒作运载体进行基因转移.如何检验目的基因是否成功的转入到受体细菌的细胞中? . 自贡市2006级诊断性考试理科综合能力测试答案 第I卷
网址:http://m.1010jiajiao.com/timu3_id_37186[举报]
实验室配制80 mL 0.1 mol/L的FeSO4溶液,请回答以下问题.
(1)请画出实验用到的最主要的仪器.
(2)实验中用托盘天平称量的绿矾(FeSO4·7H2O)的质量为________.
(3)定容的操作是________.
(4)分析以下操作对配制的溶液浓度造成的影响(填“偏高”、“无影响”、“偏低”)
①蒸馏水洗完容量瓶后没有烘干________
②转移溶液过程中出现漏液________
③未用蒸馏水洗涤烧杯________
④定容时俯视(视线偏高)________
⑤摇匀后发现液面降低,再加蒸馏水________
(2009?肇庆一模)某探究小组同学用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速率的因素.
实验药品:2.0moL/L盐酸、4.0mol/L盐酸、2.0mol/L硫酸、4.0mol/L硫酸,质量和相同的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0mL,金属用量均为9.0g.
(Ⅰ)甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
 请回答:
请回答:
(1)写出铝与盐酸反应的离子方程式
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是
(3)以上探究铝与稀盐酸、稀硫酸反应速率有差异,你认为其原因有哪些可能?请提出你的假设(说出2种可能):
(Ⅱ)(1)乙同学设计了如下影响反应速率因素的实验(温度控制为25℃和35℃).请你根据实验目的帮助该同学完成以下实验设计表(用量:酸均为50.0mL、铝为9.0g过量):
(2)如图为实验①的“H2-t”曲线图,若上述反应浓度减少一倍,速率是原来的
;温度每升高10℃,反速率是原来的2倍.请在答题卡的座标中画出实验②和实验③的“H2-t”曲线图
 .
.
查看习题详情和答案>>
实验药品:2.0moL/L盐酸、4.0mol/L盐酸、2.0mol/L硫酸、4.0mol/L硫酸,质量和相同的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0mL,金属用量均为9.0g.
(Ⅰ)甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 4.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 反应结束 |
| 2.0mol/L硫酸 | 无明显现象 | 极少量气泡 | 少量气泡 | ||
| 4.0mol/L硫酸 | 无明显现象 | 少量气泡 | 有比较连续的气泡 | ||
 请回答:
请回答:(1)写出铝与盐酸反应的离子方程式
2Al+6H+=2Al3++3H2↑
2Al+6H+=2Al3++3H2↑
.(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是
反应放热使溶液温度升高,从而使化学反应速率加快
反应放热使溶液温度升高,从而使化学反应速率加快
.(3)以上探究铝与稀盐酸、稀硫酸反应速率有差异,你认为其原因有哪些可能?请提出你的假设(说出2种可能):
Cl-能够促进金属铝与H+反应,或SO42-对H+与金属铝的反应起阻碍作用等
Cl-能够促进金属铝与H+反应,或SO42-对H+与金属铝的反应起阻碍作用等
.(Ⅱ)(1)乙同学设计了如下影响反应速率因素的实验(温度控制为25℃和35℃).请你根据实验目的帮助该同学完成以下实验设计表(用量:酸均为50.0mL、铝为9.0g过量):
| 实验目的 | 实验 编号 |
温度 | 金属铝 形态 |
盐酸浓度 /mol?L-1 |
| (1)实验①和②探究盐酸浓度对该反应速率的影响; (2)实验①和③探究温度对该反应速率的影响; (3)实验①和④探究金属规格(铝片、铝粉)对该反应速率的影响. |
① | 25?C | 铝片 | 4.0 |
| ② | 25?C 25?C |
铝片 铝片 |
2.0 2.0 | |
| ③ | 35℃ 35℃ |
铝片 铝片 |
4.0 4.0 | |
| ④ | 25?C 25?C |
铝粉 铝粉 |
4.0 4.0 |
| 1 |
| 2 |


(1)取一个100mL的大量筒,用排饱和食盐水的方法先后收集20mLCH4和80mLCl2,放在光亮的地方(不在阳光直射的地方),等待片刻,描述可能观察发生的现象.
(2)利用下列反应:Fe+Cu2+═Fe2++Cu 制一个化学电池(给出若干导线,电极材料和电解液自选),画出实验装置图,注明电解质溶液名称和正负极材料,标出电子流动方向,写出电极反应式. ,负极反应为Fe-2e-═Fe2+,正极反应为Cu2++2e-═Cu
,负极反应为Fe-2e-═Fe2+,正极反应为Cu2++2e-═Cu ,负极反应为Fe-2e-═Fe2+,正极反应为Cu2++2e-═Cu.
,负极反应为Fe-2e-═Fe2+,正极反应为Cu2++2e-═Cu.
查看习题详情和答案>>
气体颜色变浅、由油状液体生成、量筒内有白雾、量筒内液面上升
气体颜色变浅、由油状液体生成、量筒内有白雾、量筒内液面上升
(2)利用下列反应:Fe+Cu2+═Fe2++Cu 制一个化学电池(给出若干导线,电极材料和电解液自选),画出实验装置图,注明电解质溶液名称和正负极材料,标出电子流动方向,写出电极反应式.
 ,负极反应为Fe-2e-═Fe2+,正极反应为Cu2++2e-═Cu
,负极反应为Fe-2e-═Fe2+,正极反应为Cu2++2e-═Cu ,负极反应为Fe-2e-═Fe2+,正极反应为Cu2++2e-═Cu
,负极反应为Fe-2e-═Fe2+,正极反应为Cu2++2e-═Cu 为测定碳酸钙纯度(设所含杂质为SiO2),同学们设计了如下两个实验方案:
为测定碳酸钙纯度(设所含杂质为SiO2),同学们设计了如下两个实验方案:【方案I】
(1)组装发生并测定生成气体体积的实验装置,并检验气密性;
(2)称取碳酸钙样品W g;
(3)加入过量盐酸;
(4)收集并测定生成的气体体积V mL.
问题I-1:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会
问题I-2:在方框中画出测定生成的气体体积的装置简图.
【方案II】
(1)称取碳酸钙样品Wg;
(2)在锥形瓶中用C mol/L盐酸V mL(过量)溶解样品;
(3)加入甲基橙作指示剂,再用浓度为C1mol/L的标准氢氧化钠溶液滴定过量的盐酸,用去氢氧化钠溶液V1毫升.(已知甲基橙的变色范围是pH=3.1~4.4)
问题II-1:未滤去不溶物SiO2,对测定结果是否有影响?(填有或无)
理由是
问题II-2:碳酸钙纯度表达式
【方案评价】
你认为以上两个方案中,最好的方案是
另一个方案不够好的理由是
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题.
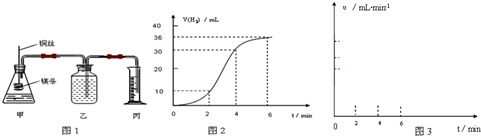
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中.足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示.
①请在图3 的方框中画出上述反应的速率与时间的关系曲线.并标出纵坐标的刻度值
②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因:
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快.他决定对其原因进行探究.填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:
②该同学设计并进行了两组实验,即得出了正确结论.他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化.若观察到实验a中
查看习题详情和答案>>

(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中.足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示.
①请在图3 的方框中画出上述反应的速率与时间的关系曲线.并标出纵坐标的刻度值
②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因:
镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大;4min后由于溶液中H+浓度降低,所以导致反应速率减小
镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大;4min后由于溶液中H+浓度降低,所以导致反应速率减小
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快.他决定对其原因进行探究.填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:
Cl-对反应没有影响,而SO42-对反应具有阻碍作用
Cl-对反应没有影响,而SO42-对反应具有阻碍作用
;原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:
Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大)
Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大)
.②该同学设计并进行了两组实验,即得出了正确结论.他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化.若观察到实验a中
反应速率加快
反应速率加快
,实验b中反应速率减慢
反应速率减慢
,则说明原因Ⅲ是正确的.依此类推.该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用.