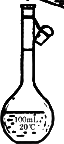题目内容
实验室配制80 mL 0.1 mol/L的FeSO4溶液,请回答以下问题.
(1)请画出实验用到的最主要的仪器.
(2)实验中用托盘天平称量的绿矾(FeSO4·7H2O)的质量为________.
(3)定容的操作是________.
(4)分析以下操作对配制的溶液浓度造成的影响(填“偏高”、“无影响”、“偏低”)
①蒸馏水洗完容量瓶后没有烘干________
②转移溶液过程中出现漏液________
③未用蒸馏水洗涤烧杯________
④定容时俯视(视线偏高)________
⑤摇匀后发现液面降低,再加蒸馏水________
答案:
解析:
解析:
|
(1)
(容积、温度、刻度线、瓶塞、梨形各1分,共5分) (2)2.8 g(3分) (3)当液面离刻度线1~2 cm时,改用胶头滴管逐滴加蒸馏水至凹液面最低点与刻度线相切(3分) (4)无影响,偏低,偏低,偏高,偏低(各1分,共5分) |

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
(11分)实验室需要0.80 mol/L NaOH溶液475 mL和0.40 mol/L硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题: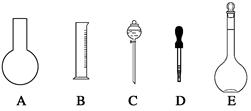
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液需用到的玻璃仪器除上述列出的仪器和玻璃棒外,还需要用到的玻璃仪器是 (填仪器名称)。
(2)下列操作中,容量瓶所不具备的功能有 (填序号)。
| A.配制一定体积准确浓度的标准溶液 |
| B.量取一定体积的液体 |
| C.测量容量瓶规格以下的任意体积的液体 |
| D.准确稀释某一浓度的溶液 |
(3)根据计算用托盘天平称取NaOH的质量为 g。在实验中其他操作均正确,若定容时俯视视刻度线,则所得溶液浓度 0.8 mol/L(填“大于”、“等于”或“小于”,下同)。若定容时,有少许蒸馏水洒落在容量瓶外,则所得溶液浓度 0.8 mol/L。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为 mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL、50 mL量筒,应选用 mL量筒最好。