题目内容
 为测定碳酸钙纯度(设所含杂质为SiO2),同学们设计了如下两个实验方案:
为测定碳酸钙纯度(设所含杂质为SiO2),同学们设计了如下两个实验方案:【方案I】
(1)组装发生并测定生成气体体积的实验装置,并检验气密性;
(2)称取碳酸钙样品W g;
(3)加入过量盐酸;
(4)收集并测定生成的气体体积V mL.
问题I-1:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会
问题I-2:在方框中画出测定生成的气体体积的装置简图.
【方案II】
(1)称取碳酸钙样品Wg;
(2)在锥形瓶中用C mol/L盐酸V mL(过量)溶解样品;
(3)加入甲基橙作指示剂,再用浓度为C1mol/L的标准氢氧化钠溶液滴定过量的盐酸,用去氢氧化钠溶液V1毫升.(已知甲基橙的变色范围是pH=3.1~4.4)
问题II-1:未滤去不溶物SiO2,对测定结果是否有影响?(填有或无)
理由是
问题II-2:碳酸钙纯度表达式
【方案评价】
你认为以上两个方案中,最好的方案是
另一个方案不够好的理由是
分析:【方案Ⅰ】、问题I-1如果称量样品时,砝码底部有一处未被实验者发现的残缺,依据天平称量原理分析,称量出物质的质量减小;
问题I-2测定生成的气体体积的装置是测定反应生成二氧化碳气体的条件,可以利用排饱和碳酸氢钠溶液的方法测定,据此画出装置图;
【方案Ⅱ】问题II-1:酸碱中和反应终点是利用指示剂变色确定,滴定终点为弱酸性,不能溶解二氧化硅,二氧化硅不与氢氧化钠溶液反应,不需要过滤;
问题II-2:碳酸钙纯度依据实验过程中计算和碳酸钙反应的盐酸,依据碳元素守恒得到碳酸钙含量;
【方案评价】分析判断方案Ⅱ测定结果更准确,方案Ⅰ气体测定会产生加大误差;
问题I-2测定生成的气体体积的装置是测定反应生成二氧化碳气体的条件,可以利用排饱和碳酸氢钠溶液的方法测定,据此画出装置图;
【方案Ⅱ】问题II-1:酸碱中和反应终点是利用指示剂变色确定,滴定终点为弱酸性,不能溶解二氧化硅,二氧化硅不与氢氧化钠溶液反应,不需要过滤;
问题II-2:碳酸钙纯度依据实验过程中计算和碳酸钙反应的盐酸,依据碳元素守恒得到碳酸钙含量;
【方案评价】分析判断方案Ⅱ测定结果更准确,方案Ⅰ气体测定会产生加大误差;
解答:解:【方案Ⅰ】、问题I-1如果称量样品时,砝码底部有一处未被实验者发现的残缺,依据天平称量原理分析,砝码质量减小,称量出物质的质量减小,所以那么测定的碳酸钙的纯度会偏低;
故答案为:偏低;
问题I-2;测定生成的气体体积的装置是测定反应生成二氧化碳气体的条件,可以利用排饱和碳酸氢钠溶液的方法测定,导气管短进长出装置图为: ;
;
故答案为: ;
;
【方案Ⅱ】问题II-1:酸碱中和反应终点是利用指示剂甲基橙变色确定,甲基橙的变色范围是pH=3.1~4.4,滴定终点为弱酸性,不能溶解二氧化硅,二氧化硅不与氢氧化钠溶液反应,不需要过滤;
故答案为:无,甲基橙变色时,溶液呈弱酸性,此时SiO2不会与氢氧化钠溶液发生反应;
问题II-2:称取碳酸钙样品Wg,在锥形瓶中用C mol/L盐酸V mL(过量)溶解样品,加入甲基橙作指示剂,再用浓度为C1mol/L的标准氢氧化钠溶液滴定过量的盐酸,用去氢氧化钠溶液V1毫升,所以溶解碳酸钙需要的氯化氢物质的量=Cmol/L×V×10-3L-C1mol/L×V1×10-3L,CaCO3+2HCl=CaCl2+H2O+CO2↑,则碳酸钙物质的量=0.5(Cmol/L×V×10-3L-C1mol/L×V1×10-3L),碳酸钙纯度=
×100%=
×100%;
故答案为:
×100%;
【方案评价】对比实验方案,分析判断方案Ⅱ测定结果更准确;方案Ⅰ中气体体积难于准确测定,实验操作复杂,不易准确测定;
故答案为:方案II,测量生成的CO2的体积操作较繁琐,误差较大;计算时还需将其折算成标准状况时的体积,比较复杂.
故答案为:偏低;
问题I-2;测定生成的气体体积的装置是测定反应生成二氧化碳气体的条件,可以利用排饱和碳酸氢钠溶液的方法测定,导气管短进长出装置图为:
 ;
;故答案为:
 ;
;【方案Ⅱ】问题II-1:酸碱中和反应终点是利用指示剂甲基橙变色确定,甲基橙的变色范围是pH=3.1~4.4,滴定终点为弱酸性,不能溶解二氧化硅,二氧化硅不与氢氧化钠溶液反应,不需要过滤;
故答案为:无,甲基橙变色时,溶液呈弱酸性,此时SiO2不会与氢氧化钠溶液发生反应;
问题II-2:称取碳酸钙样品Wg,在锥形瓶中用C mol/L盐酸V mL(过量)溶解样品,加入甲基橙作指示剂,再用浓度为C1mol/L的标准氢氧化钠溶液滴定过量的盐酸,用去氢氧化钠溶液V1毫升,所以溶解碳酸钙需要的氯化氢物质的量=Cmol/L×V×10-3L-C1mol/L×V1×10-3L,CaCO3+2HCl=CaCl2+H2O+CO2↑,则碳酸钙物质的量=0.5(Cmol/L×V×10-3L-C1mol/L×V1×10-3L),碳酸钙纯度=
| (CV-C1V1)×10-3×0.5×100 |
| W |
| 0.05(CV-C1V1) |
| W |
故答案为:
| 0.05(CV-C1V1) |
| W |
【方案评价】对比实验方案,分析判断方案Ⅱ测定结果更准确;方案Ⅰ中气体体积难于准确测定,实验操作复杂,不易准确测定;
故答案为:方案II,测量生成的CO2的体积操作较繁琐,误差较大;计算时还需将其折算成标准状况时的体积,比较复杂.
点评:本题考查了实验探究物质组成的实验设计和测定方法,⑩⑩⑩?实验探究物质存在和性质的实验设计和分析判断,注意实验过程中的数据应用,掌握基础是关键,题目难度中等.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目

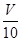 mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。