摘要:aA (一)化学平衡的图象问题研究 1. 作用:化学反应速率和化学平衡的有关理论具有一定的抽象性..运用各种图象能直观地反映可逆反应的变化规律及特点..能从定性和定量两方面来分析和研究变化的因素.方向和程度. 2.方法: (1)注重纵坐标和横坐标所对应的物理量.,只要其中一个物理量改变.就可能导致图象的改变. 例如 对一可逆反应从起始到达平衡.某反应物的A的百分含量).A的转化率aA分别对时间作图.曲线正好相反. t t1 t A的百分含量与时间关系 A的转化率与时间关系 (2)弄清纵坐标和横坐标两种物理量之间的相互关系..作图或析图时要注意变化的方向.趋势.程度..如考虑是直线还是曲线?是上升还是下降?到一定时是否会不再改变?若是两条或两条以上的直线.斜率是否相同?若是两曲线.它们的曲率是否相等?--这一系列的问题必须思考清楚.. (3)抓住关键的点:如原点.最高点.最低点.转折点.交点等..同样有一系列问题值得去好好思考.如该不该通过原点?有没有最高点?为何有转折点.交点等?3.图象类型 纵坐标--反应速率或某成分的百分含量(A%) 或某反应物的转化率(aA) 特点: ①可逆反应从非平衡到达平衡以前.v.C.A% .aA均随时间(t)变化.到达平衡后.则不随时间而改变..图象中一定将出现平行于横坐标的直线.简称“平台 . ②出现转折“平台 的先后取决于达到平衡所需要的时间.而时间的长短又取决于反应速率的大小. 温度越大.V正.V逆越大.t越小 压强越大.V正.V逆越大.t越小 T.P一定.使用正催化剂后V正.V逆均增大.t缩小. ③“平台 的相对高低.则由外界条件对平衡的影响来决定.“平台 越高.说明条件越有利于纵坐标对应物理量的提高.反之.则不利. 故可根据图象特点来分析可逆反应特点. 例1 已知某可逆反应mA+Q在密闭容器中进行反应.测得在不同时间t.温度T和压强P与反应物B在混合气中的百 分含量B%的关系曲线如图所示. A.T1<T2,P1>P2,m+n>P,Q<0 B.T1> T2,P2>P1,m+n<P,Q<0 C.T2> T1,P2>P1,m+n<P,Q<0 D.T1> T2,P2>P1,m+n>P,Q>0 解析:①根据达到平衡的时间长短,可断定 T2<T1,P2>P1 ②根据“平台 高低.可断定 低温有利于B%增大.说明逆反应是放热反应.即正反应为吸热.Q<0 高压有利.B%增大,说明增大压强,平衡逆移.故m+n<P. 由此可知.本题答案: 例2 如图所示,a曲线表示一定条件下可逆反 应:X+Q的反应过程中X 的转化率和时间的关系.若使a曲线变为b曲线,可 采取的措施是 [ ] A.加入催化剂 B.增大Y的浓度 C.降低温度 D.增大体系压强 解析:①达平衡所需时间b<a 正逆反应速率Vb >Va ②改变条件后ax不变 平衡不移动 ③该可逆反应ΔVg=0 可加催化剂或加压 答案: 在反应速率图象中.在保持平衡的某时刻t1改变某一条件前后.V正.V逆的变化有两种: V正.V逆同时突破--温度.压强.催化剂的影响 V正.V逆之一渐变--一种成分浓度的改变 现图示如下: 图 改变条件 增加反应物浓度 降低生成物浓度 升温或加压(Δng≠0) 降温或减压(Δng≠0) 使用正催化剂或加压(Δng=0) 使用负催化剂或减压(Δng=0) (5)在浓度C-时间t图象中 改变温度瞬间.各物浓度不变.故平衡虽破坏.但各物质的浓度变化均连续. 改变压强瞬间.各物质浓度均突变.加压--突增.减压--突减. 改变某一成分浓度时.该成分浓度突变.其它物质不变.故变化是连续的. 例 3. 可逆反应N2+3H2 2NH3+Q,从反应开始经t1秒达平衡状态.因条件改变.平衡在t2秒时发生移动.在t3秒时.又达到新的平衡状态.试根据t2-t3秒曲线判断.下列图1.图2所表示的平衡移动方向和变化条件各是什么? 图1 图2 解析 图1中t2-t3曲线与原来连续变化.说明只可能为改变 引起.NH3浓度下降,H2浓度增大,说明平衡是逆向移动,故变化的条件是 . 图2中 ,t2时改变条件前后NH3的浓度连续变化.而N2浓度突变.说明只能是增加 浓度引起.平衡正向移动. 例 5.气态反应A+B C+D,其它条件不变.在有催化剂条件时的反应过程中,有关的量的变化情况错误的是[ ] 解析:使用催化剂.同等程度改变正逆反应速度.缩短达到平衡所需时间.但不改变平衡状态.故不论有无催化剂.达到平衡时同一成分的百分含量相同.所以选项A错 对.选项D中似乎达平衡所需时间长短合理.但使用催化剂.反应速率不但不增大.反而减小.显然不合理.本题正确选项: 例6..2.右图为条件一定时,反应 2NO+O2 2NO2+Q中NO的最大转 化率与温度变化关系曲线图,图中有A.B.C.D. E五点.其中表示未达到平衡状态.且V正<V逆的 点是[ ] A.B和C B.A和E C.E D.A和C 解析:当条件一定时.反应的最大转化率一定是达平衡状态时.该图像与初中所学的溶解度曲线很相似.A.D所在的曲线上所有的点均为平衡时的状态.曲线上下的点均为非平衡时的状态.反应从非平衡自发达平衡.从图中可看出.B.C所在状态的转化率小于该温度平衡时.说明反应正向 方向移动.即V正>V逆.而E所在状态的转化率大于该温度平衡时的.说明反应正向逆反应方向移动.即V正<V逆.故本题选 .. (2)横标--温度T 纵标--百分含量A% 或转化率aA 或反应速率C 特点:①横坐标为T时.纵标对应的各物理量均随T变化而变化. ②若测得在不同温度下经过足够长时间达平衡时A%.αA.C均随T单调变化. ③若测得在不同温度下经过同一时间在某一时刻测得A%.αA.C随T变化而可能呈现先上升→达最高点→ 下降的变化趋势 例7. 下图表示外界条件的变化对下列反应的影响. L-Q 在图中Y轴是指 A.平衡混合气中R的质量分数 B.平衡混合气中G的体积分数 C.G的转化率 D.L的转化率 解析 由图象可知:T↗,Y↓. G%↓,R%↗. 由反应可知:T↗,平衡正移. 反应物α↗. 答案: 例5 在容积相同的五个密闭容器中分别放 入同量的A2和B2.在不同温度下同时任其发生 反应:A2(g)+3B2(g) 2AB3(g).分别在 某一同时刻测得其中AB3所占的体积分数变化 如图所示.下列说法不正确的是 [ ] A.正反应是放热反应 B.E.F二点尚未达到平衡 C.H.I二点尚未达到平衡 D.G.H.I三点可能已达平衡状态 解析 随着温度的升高反应速率加快.从G到H.I.AB3%所占的体积分数降低.能得出正反应是放热反应,E.F两点AB3%比G点低.原因是低温下反应速率慢.反应未达平衡状态.选 (二)解决化学平衡问题的重要思维方法 1.可逆反应“不为零 原则. 可逆性是化学平衡的前提.达到平衡时应是反应物和生成物共存的状态.每种物质的量不为零. 一般可用极限分析法推断. 即假设反应不可逆.则最多生成产物多少.有无反应物剩余.余多少.这样的极值点是不可能达到的.故可用确定某些范围或在范围中选择合适的量. 例3 在一定温度下将1 molCO和1mol水蒸气放在密闭容器中反应:CO+H2O CO2+H2,达平衡后测得CO2为0.6mol.再通入4mol水蒸气.达新平衡后CO2的物质的量可能是[ ] A.0.6mol B.1mol C.0.8mol D.1.2mol 解析 加入H2O(g)平衡正移.n·CO2>0.6mol但不可能任意增大,根据“不为零 原则.1molCO即使完全反应也只可能生成1molCO2.所以0.6mol<nCO2<1mol.答案 合适. 2.“一边倒 原则 可逆反应.在条件相同时.若达到等同平衡.其初始状态必须能互变.从极限角度看.就是各物质的物质的量要相当.因此可以采用一边倒的原则来处理以下问题: (1)化学平衡等同条件+bB ①始 a b 0 平衡态Ⅰ ②始 0 0 c 平衡态Ⅱ ③始 x y z 平衡态Ⅲ 为了使平衡Ⅲ =Ⅱ=Ⅰ 根据“一边倒 原则.即可得 x+z=a +=1 y+z=b +=1 例8 温度.催化剂不变.向某一固定体积的密闭容器内按下列各组物质的量加入H2.N2.NH3.反应达平衡时,氨气浓度最大的一组是[ ] A B C D H2 6 1 3.5 5 N2 2 0 1 1.5 NH3 0 4 2 1 解析 2NH3 N2+3H2.根据反应“一边倒 换算. B 0 2 6+1=7 C 0 2 3+3.5=6.5 D 0 2 1.5+5=6.5 由此可知.符合题意的是
网址:http://m.1010jiajiao.com/timu3_id_371799[举报]
具有明显现象的官能团特征反应常被用来鉴定化合物.
①欲区分CH3CH2OH和CH3CHO,应选用
A.NaOH溶液 B.银氨溶液 C.盐酸
请写出其反应方程式:
②欲区分 和
和 ,应选用
,应选用
a.KMnO4溶液 b.溴水 c.Na2CO3溶液
③欲区分 和
和 ,应选用
,应选用
a.AgNO3溶液 b.NaOH溶液 c.饱和溴水
请写出其反应方程式:
 .
.
查看习题详情和答案>>
①欲区分CH3CH2OH和CH3CHO,应选用
B
B
(填字母).A.NaOH溶液 B.银氨溶液 C.盐酸
请写出其反应方程式:
CH3CHO+2Ag(NH3)2OH→CH3COONH4+2Ag↓+3NH3↑+H20
CH3CHO+2Ag(NH3)2OH→CH3COONH4+2Ag↓+3NH3↑+H20
②欲区分
 和
和 ,应选用
,应选用a
a
(填字母).a.KMnO4溶液 b.溴水 c.Na2CO3溶液
③欲区分
 和
和 ,应选用
,应选用c
c
(填字母).a.AgNO3溶液 b.NaOH溶液 c.饱和溴水
请写出其反应方程式:


(1)水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+).下列对上述过程的描述不合理的是(
A.水分子中原氧原子与氢原子之间的化学键发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(2)随着人类对水的研究的不断深入,水的应用也越来越广泛.研究人员最近发现,在一定的实验条件下,给水施加一个弱电场,在20℃、1个大气压下,水可以结成冰,称为“热冰”.“热冰”有许多实用价值,如开发新药、用于纳米打印机等,还可能用来
A.代替干冰 B.防止冰川熔化 C.在室温下制作冰雕 D.建室温溜冰场
(3)在灾害性事故中,骨折时有发生,通常用石膏来固定骨折部位.石膏可分为熟石膏(CaSO4?
H2O,一种白色粉末)和生石膏(CaSO4?2H2O,一种坚硬的固体)两种,医生使用的石膏是
(4)火星探测车在火星大气中检测到了气体A.资料显示,A分子是三原子分子,其相对分子质量为60,在地球环境下A易分解.粉未状的KSCN与浓硫酸在一定条件下可得到气体A和二种硫酸氢盐,生成物的物质的量之比是1:1:1.则气体A的结构式是
(5)新型离子化合物[HC60]+[CB11H60Cl60]-是一种功能材料.它可以用超酸H(CB11H60Cl60)和C60反应,使C60得到质子来制取.该反应类型跟中学课本中的一个化学反应类似,课本中的这个反应是(写一个化学方程式)
查看习题详情和答案>>
A
A
)A.水分子中原氧原子与氢原子之间的化学键发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(2)随着人类对水的研究的不断深入,水的应用也越来越广泛.研究人员最近发现,在一定的实验条件下,给水施加一个弱电场,在20℃、1个大气压下,水可以结成冰,称为“热冰”.“热冰”有许多实用价值,如开发新药、用于纳米打印机等,还可能用来
CD
CD
(填写序号)A.代替干冰 B.防止冰川熔化 C.在室温下制作冰雕 D.建室温溜冰场
(3)在灾害性事故中,骨折时有发生,通常用石膏来固定骨折部位.石膏可分为熟石膏(CaSO4?
| 1 | 2 |
熟石膏
熟石膏
(填分子式或名称).石膏定型时发生的化学反应方程式2CaSO4?H2O+3H2O=2CaSO4?2H2O
2CaSO4?H2O+3H2O=2CaSO4?2H2O
.(4)火星探测车在火星大气中检测到了气体A.资料显示,A分子是三原子分子,其相对分子质量为60,在地球环境下A易分解.粉未状的KSCN与浓硫酸在一定条件下可得到气体A和二种硫酸氢盐,生成物的物质的量之比是1:1:1.则气体A的结构式是
S=C=O
S=C=O
.(5)新型离子化合物[HC60]+[CB11H60Cl60]-是一种功能材料.它可以用超酸H(CB11H60Cl60)和C60反应,使C60得到质子来制取.该反应类型跟中学课本中的一个化学反应类似,课本中的这个反应是(写一个化学方程式)
NH3+HCl=NH4Cl
NH3+HCl=NH4Cl
.(1)有下列七种物质:A.干冰 B.氧化镁 C.氯化铵 D.固态碘 E.烧碱 F.冰 G.过氧化钾
①熔化时需要破坏共价键和离子键的是
②熔点最低的是
④只含有极性键的是
⑥以分子形式存在的是:
(2)依下列条件回答下列问题①A、B、C三种元素原子序数依次为a、b、c,它们对应离子具有相同的电子层结构An+、Bn-、Cm-,且n>m,则原子序数由小至大的顺序为:
②元素A中子数为a,简单离子核外共有x个电子,带+n个电荷,则该微粒可表示为:

③X、Y、Z三种短周期元素,原子序数依次增大,它们的最高价氧化物对应水化物两两能发生反应,则X、Y、Z元素符号依次是:
④R元素的最高价氧化物对应水化物的化学式为HnROn,则它对应的气态氢化物的化学式为:
查看习题详情和答案>>
①熔化时需要破坏共价键和离子键的是
C
C
(填序号,下同);②熔点最低的是
A
A
;③既有离子键又有共价键的是CEG
CEG
;④只含有极性键的是
AF
AF
;⑤含非极性键的是DG
DG
.⑥以分子形式存在的是:
ADF
ADF
(2)依下列条件回答下列问题①A、B、C三种元素原子序数依次为a、b、c,它们对应离子具有相同的电子层结构An+、Bn-、Cm-,且n>m,则原子序数由小至大的顺序为:
b<a<c
b<a<c
②元素A中子数为a,简单离子核外共有x个电子,带+n个电荷,则该微粒可表示为:


③X、Y、Z三种短周期元素,原子序数依次增大,它们的最高价氧化物对应水化物两两能发生反应,则X、Y、Z元素符号依次是:
N、Na、Al或Na、Al、S或Na、Al、Cl
N、Na、Al或Na、Al、S或Na、Al、Cl
.④R元素的最高价氧化物对应水化物的化学式为HnROn,则它对应的气态氢化物的化学式为:
H(8-n)R或RH(8-n)
H(8-n)R或RH(8-n)
. Ⅰ:如图表示800℃时,A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答:
Ⅰ:如图表示800℃时,A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答:(1)该反应的反应物是
A
A
.(2)反应物的转化率是
40%
40%
.(3)该反应的化学方程式为
2A?B+3C
2A?B+3C
.Ⅱ:(7分)在体积为2L的恒容密闭容器中存在以下反应:
CH3OH(g)+H2O(g)?CO2(g)+3H2(g);该反应的正反应为吸热反应,请根据题目要求回答下列问题:
(1)判断该可逆反应达到平衡状态的依据是(填序号)
CD
CD
.A.v正(CH3OH)=v正(CO2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.CH3OH、H2O、CO2、H2的浓度都不再发生变化
(2)在一定条件下,当该反应处于化学平衡状态时,下列操作可使化学平衡向逆反应方向移动的是
BCF
BCF
(填序号).A.升高温度 B.降低温度 C.增大压强 D.减小压强 E.加入催化剂 F.移出水蒸气.
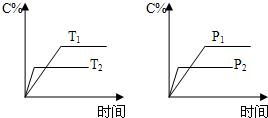 可逆反应aA(s)+2B(g)?2C(g)+D(g),其中a为正整数.反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
可逆反应aA(s)+2B(g)?2C(g)+D(g),其中a为正整数.反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )