摘要:常温下.向10mLpH=4的一元强酸HA中加入VmLpH=10的一元强碱BOH溶液.若混合溶液的pH=7(混合溶液体积设为V总mL.假定V总=10+V).则对反应后的溶液的叙述正确的是( ) A.c(H+)=c(OH-)=c(A-)=c(B+) B. c(A-)=c(B+) C.V总 < 20mL D.V总 = 20mL
网址:http://m.1010jiajiao.com/timu3_id_371626[举报]
A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
①将1L pH=3的A溶液分别与0.001mol/L x L B溶液、0.001mol/L y L D溶液充分反应至中性,x、y的大小关系式y<x;
②浓度均为0.1mol/L A和E溶液,pH:A<E
③浓度均为0.1mol/L C和D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)C是
(2)用水稀释0.1mol/L B溶液时,溶液中随水量的增加而减小的是
A.
B.
C.c (H+)?c (OH-) D.n (OH-)
(3)等pH、等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同.则
(4)常温下,向0.01mol/L C溶液中滴加0.01mol/L D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为
(5)已知常温下Mg(OH)2在pH=12的D溶液中Mg2+的浓度为1.8×10-7mol/L,则 Ksp[Mg(OH)2]=
查看习题详情和答案>>
①将1L pH=3的A溶液分别与0.001mol/L x L B溶液、0.001mol/L y L D溶液充分反应至中性,x、y的大小关系式y<x;
②浓度均为0.1mol/L A和E溶液,pH:A<E
③浓度均为0.1mol/L C和D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)C是
NH4HSO4
NH4HSO4
溶液,D是NaOH
NaOH
溶液.(2)用水稀释0.1mol/L B溶液时,溶液中随水量的增加而减小的是
AB
AB
.A.
| c(B) |
| c(OH-) |
| c(OH-) |
| c(H+) |
(3)等pH、等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同.则
HCl
HCl
(填化学式)溶液中锌粉有剩余.(4)常温下,向0.01mol/L C溶液中滴加0.01mol/L D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为
c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-)
c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-)
.(5)已知常温下Mg(OH)2在pH=12的D溶液中Mg2+的浓度为1.8×10-7mol/L,则 Ksp[Mg(OH)2]=
1.8×10-11(mol/L)3
1.8×10-11(mol/L)3
. 下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl(1)属于弱电解质的是
③④
③④
,溶液呈碱性的有②④⑤
②④⑤
(填序号).(2)常温下0.01mol/L HCl溶液的PH=
2
2
;pH=11的CH3COONa溶液中由水电离产生的c(OH-)=10-3mol/L
10-3mol/L
.(3)用离子方程式表示CH3COONa溶液呈碱性的原因
CH3COO?+H2O?CH3COOH+OH?
CH3COO?+H2O?CH3COOH+OH?
,其溶液中离子浓度按由大到小的顺序为c(Na+)>c(CH3COO?)>c(OH-)>c(H+)
c(Na+)>c(CH3COO?)>c(OH-)>c(H+)
.(4)将等pH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的PH仍相等,则m
小于
小于
n (填“大于、等于、小于”).(5)常温下,向100mL 0.01mol?L-1HA溶液逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
①由图中信息可知HA为
强
强
酸(填“强”或“弱”).②K点对应的溶液中,c(M+)+c(MOH)=
0.01
0.01
mol?L-1.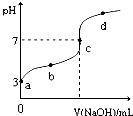 已知常温下CH3COOH的电离平衡常数为Ka,常温下,向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )
已知常温下CH3COOH的电离平衡常数为Ka,常温下,向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )| A、a点表示的溶液中由水电离出的H+浓度为1.0×10-3mol?L-1 | ||
| B、b点表示的溶液c(CH3COO-)<c(Na+) | ||
| C、c点表示CH3COOH和NaOH恰好反应完全 | ||
D、b、d点表示的溶液中
|
常温下,向100mL0.05mol/L氢硫酸中逐渐通入氯气.下列叙述正确的是( )
| A、溶液pH先变大后变小 | B、溶液导电能力逐渐增强 | C、氢硫酸完全反应生成1.6g硫 | D、反应的离子方程式为:S2-+Cl2→2Cl-+S↓ |