题目内容
 下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl
下列化合物:①HCl ②NaOH ③CH3COOH ④NH3?H2O ⑤CH3COONa ⑥NH4Cl(1)属于弱电解质的是
③④
③④
,溶液呈碱性的有②④⑤
②④⑤
(填序号).(2)常温下0.01mol/L HCl溶液的PH=
2
2
;pH=11的CH3COONa溶液中由水电离产生的c(OH-)=10-3mol/L
10-3mol/L
.(3)用离子方程式表示CH3COONa溶液呈碱性的原因
CH3COO?+H2O?CH3COOH+OH?
CH3COO?+H2O?CH3COOH+OH?
,其溶液中离子浓度按由大到小的顺序为c(Na+)>c(CH3COO?)>c(OH-)>c(H+)
c(Na+)>c(CH3COO?)>c(OH-)>c(H+)
.(4)将等pH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的PH仍相等,则m
小于
小于
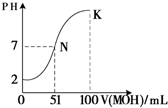
n (填“大于、等于、小于”).(5)常温下,向100mL 0.01mol?L-1HA溶液逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
①由图中信息可知HA为
强
强
酸(填“强”或“弱”).②K点对应的溶液中,c(M+)+c(MOH)=
0.01
0.01
mol?L-1.分析:(1)在水溶液里和熔融状态下只有部分电离的电解质是弱电解质,碱或强碱弱酸盐其溶液都呈碱性;
(2)pH=-lgc(H+);醋酸钠促进水电离,根据氢离子浓度结合水的离子积常数计算氢氧根离子浓度;
(3)醋酸钠是强碱弱酸盐,醋酸根离子水解而使其溶液呈碱性,根据电荷守恒确定离子浓度大小;
(4)醋酸是弱电解质,氯化氢是强电解质,醋酸存在电离平衡,氯化氢不存在电离平衡,将等pH的醋酸和盐酸稀释后溶液的pH仍然相等,则醋酸稀释的倍数大于盐酸;
(5)①根据酸的浓度和溶液的PH判断酸的强弱;
②根据物料守恒计算.
(2)pH=-lgc(H+);醋酸钠促进水电离,根据氢离子浓度结合水的离子积常数计算氢氧根离子浓度;
(3)醋酸钠是强碱弱酸盐,醋酸根离子水解而使其溶液呈碱性,根据电荷守恒确定离子浓度大小;
(4)醋酸是弱电解质,氯化氢是强电解质,醋酸存在电离平衡,氯化氢不存在电离平衡,将等pH的醋酸和盐酸稀释后溶液的pH仍然相等,则醋酸稀释的倍数大于盐酸;
(5)①根据酸的浓度和溶液的PH判断酸的强弱;
②根据物料守恒计算.
解答:解:(1)在水溶液里和熔融状态下只有部分电离的电解质是弱电解质,属于弱电解质的是一水合氨和醋酸,碱或强碱弱酸盐其溶液都呈碱性,氢氧化钠和氨水、醋酸钠溶液都呈碱性,故选:③④、②④⑤;
(2)pH=-lgc(H+)=-lg0.01=2,醋酸钠促进水电离,醋酸钠溶液中氢离子浓度为10-11mol/L,根据水的离子积常数知,氢氧根离子浓度等于10-3 mol/L,
故答案为:2、10-3 mol/L;
(3)醋酸钠是强碱弱酸盐,醋酸根离子水解生成醋酸,导致溶液中氢氧根离子浓度大于氢离子浓度而使其溶液呈碱性,水解离子方程式为:CH3COO?+H2O?CH3COOH+OH?,溶液呈碱性,所以c(OH-)>c(H+),溶液中存在电荷守恒,c(Na+)+c(H+)=c(CH3COO?)+c(OH-),则c(Na+)>c(CH3COO?),所以离子浓度大小顺序是c(Na+)>c(CH3COO?)>c(OH-)>c(H+),
故答案为:CH3COO?+H2O?CH3COOH+OH?,c(Na+)>c(CH3COO?)>c(OH-)>c(H+);
(4)醋酸是弱电解质,氯化氢是强电解质,醋酸存在电离平衡,氯化氢不存在电离平衡,将等pH的醋酸和盐酸稀释后溶液的pH仍然相等,则盐酸稀释的倍数小于醋酸,故答案为:小于;
(5)①根据图象知,0.01mol?L-1HA溶液中PH=2,氢离子浓度等于酸浓度,所以该酸是强酸,故答案为:强;
②K点时,加入的MOH的物质的量=0.02mol?L-1×0.1L=0.002mol,混合溶液的体积是0.2L,根据物料守恒知,c(M+)+c(MOH)=
=0.01mol/L,故答案为:0.01.
(2)pH=-lgc(H+)=-lg0.01=2,醋酸钠促进水电离,醋酸钠溶液中氢离子浓度为10-11mol/L,根据水的离子积常数知,氢氧根离子浓度等于10-3 mol/L,
故答案为:2、10-3 mol/L;
(3)醋酸钠是强碱弱酸盐,醋酸根离子水解生成醋酸,导致溶液中氢氧根离子浓度大于氢离子浓度而使其溶液呈碱性,水解离子方程式为:CH3COO?+H2O?CH3COOH+OH?,溶液呈碱性,所以c(OH-)>c(H+),溶液中存在电荷守恒,c(Na+)+c(H+)=c(CH3COO?)+c(OH-),则c(Na+)>c(CH3COO?),所以离子浓度大小顺序是c(Na+)>c(CH3COO?)>c(OH-)>c(H+),
故答案为:CH3COO?+H2O?CH3COOH+OH?,c(Na+)>c(CH3COO?)>c(OH-)>c(H+);
(4)醋酸是弱电解质,氯化氢是强电解质,醋酸存在电离平衡,氯化氢不存在电离平衡,将等pH的醋酸和盐酸稀释后溶液的pH仍然相等,则盐酸稀释的倍数小于醋酸,故答案为:小于;
(5)①根据图象知,0.01mol?L-1HA溶液中PH=2,氢离子浓度等于酸浓度,所以该酸是强酸,故答案为:强;
②K点时,加入的MOH的物质的量=0.02mol?L-1×0.1L=0.002mol,混合溶液的体积是0.2L,根据物料守恒知,c(M+)+c(MOH)=
| 0.002mol |
| 0.2L |
点评:本题考查了弱电解质的电离、盐类的水解、溶液的稀释等知识点,利用电荷守恒、物料守恒来分析解答即可,难度中等.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目