网址:http://m.1010jiajiao.com/timu3_id_371134[举报]
已知:25℃时,A酸的溶液pH=a,B碱的溶液pH=b.
(1)、若A为强酸,B为强碱,且a+b=14,两者等体积混合后,溶液的pH=________,此时若溶液中阳离子浓度大于阴离子浓度,其原因可能是________;强酸强碱按体积比为1∶10混合后溶液显中性,则a+b=________.
(2)、若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显酸性.则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为________;此混合溶液中,下列微粒浓度大小关系一定正确的是________(填序号):
①c(MOH)>c(M+)>c(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+c(H+)=c(R-)+c(OH-)
(14分)已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)= ,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
②25℃时,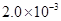 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:

请根据以下信息回答下列问题:
(1)25℃时,HF电离平衡常数的数值Ka= 。
(2)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”)
(3) mol·L-1HF溶液与
mol·L-1HF溶液与 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。
mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。
(4)已知CH3COONH4溶液为中性,又知CH3COOH溶液加到Na2CO3溶液中有气体放出,试推断NH4HCO3溶液的pH 7(填“>”、“<”或“=”);
将同温度下等浓度的四种盐溶液:?
| A.NH4Cl | B.NH4SCN? | C.CH3COONH4 | D.NH4HCO3 |
按pH由大到小的顺序排列是: (填序号) 查看习题详情和答案>>
(10分)(1)已知常温下,A酸的溶液pH=a,B碱的溶液pH=b,回答下列问题:
①若A为醋酸,B为氢氧化钠,且a=4,b=10,两者等体积混合,则混合前c(CH3COOH) c(NaOH )(填“<、=或>”,下同);混合后溶液的pH 7
②若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性,则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。
(2)①现有25℃时等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,均恰好中和,则V1、V2、V3的大小关系是 ;
②另有25℃,等体积等物质的量浓度的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,混合后溶液均呈中性,则V1、V2、V3的大小关系是 ;室温下,若生成同浓度的NaCl与NH4Cl溶液各1L, 则溶液中离子总数N(NaCl) N(NH4Cl)。(填“<、=或>”)
(1)已知常温下,A酸的溶液pH=a,B碱的溶液pH=b,回答下列问题:
①若A为醋酸,B为氢氧化钠,且a=4,b=10,两者等体积混合,则混合前c(CH3COOH) c(NaOH )(填“<、=或>”,下同);混合后溶液的pH 7。
②若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性,则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。(2)①现有25℃时等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,均恰好中和,则V1、V2、V3的大小关系是 ;
②另有25℃,等体积等物质的量浓度的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,混合后溶液均呈中性,则V1、V2、V3的大小关系是 ;③室温下,若生成同浓度的NaCl与NH4Cl溶液各1L,则溶液中离子总数N(NaCl) N(NH4Cl)。(填“<、=或>”)
查看习题详情和答案>>
(14分)已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)= ,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=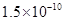
②25℃时, mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:


请根据以下信息回答下列问题:
(1)25℃时,HF电离平衡常数的数值Ka= 。
(2)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”)
(3) mol·L-1HF溶液与
mol·L-1HF溶液与 mol·L-1
CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。
mol·L-1
CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。
(4)已知CH3COONH4溶液为中性,又知CH3COOH溶液加到Na2CO3溶液中有气体放出,试推断NH4HCO3溶液的pH 7(填“>”、“<”或“=”);
将同温度下等浓度的四种盐溶液:?
A.NH4Cl B.NH4SCN? C.CH3COONH4 D.NH4HCO3
按(NH4+)由大到小的顺序排列是: (填序号)。
按pH由大到小的顺序排列是: (填序号)
查看习题详情和答案>>