题目内容
(14分)已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)= ,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=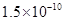
②25℃时, mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:


请根据以下信息回答下列问题:
(1)25℃时,HF电离平衡常数的数值Ka= 。
(2)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”)
(3) mol·L-1HF溶液与
mol·L-1HF溶液与 mol·L-1
CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。
mol·L-1
CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。
(4)已知CH3COONH4溶液为中性,又知CH3COOH溶液加到Na2CO3溶液中有气体放出,试推断NH4HCO3溶液的pH 7(填“>”、“<”或“=”);
将同温度下等浓度的四种盐溶液:?
A.NH4Cl B.NH4SCN? C.CH3COONH4 D.NH4HCO3
按(NH4+)由大到小的顺序排列是: (填序号)。
按pH由大到小的顺序排列是: (填序号)
(1)Ka=4×10-4。
(2)两种酸的电离度不同导致溶液中起始反应时H+浓度不同引起反应速率的不同。
c(CH3COO-)<c(SCN-)
(3)有。
(4)> ABCD DCBA
【解析】
1. 温度一定时,Ka的值是固定不变的所以Ka= 【c(H+)* c(F-)】/ c(HF),与温度无关,选取任意一点都是一样的,只不过,为了使计算简便,通常我们会选择有利于计算的一点。如果选择中间的交点,计算会更方便,因为此时c(F-)=c(HF),则Ka=c(H+)=4×10-4。
2将两种溶液分别混合后,两种溶液产生CO2气体的速率存在明显差异的原因是两种酸的电离度不同导致溶液中起始反应时H+浓度不同引起反应速率的不同。结束后所得两溶液中,c(CH3COO-)大于c(SCN-)。
3 [HF]=4x10-3 M, [H+]=10-4 M (从pH=4来), HF的Ka=4x10-4,而Ka=([H+][F-])/[HF],以上即可算出
[F-]=1.6x10-2 M,即c(F-)=1.6x10-2所以有沉淀生成。
4、CH3COOH加入Na2CO3溶液中有气体放出,说明碳酸的酸性没有醋酸强,而CH3COONH4溶液为中性,所以NH4HCO3溶液显碱性,因为由于HCO3-水解形成的碳酸的酸性没有由CH3COO-水解所形成的醋酸的酸性强,所以NH4HCO3溶液显碱性,即PH大于7
考点:化学平衡常数,盐类的水解,离子浓度的比较
点评:本题难度大,理解平衡常数的含义,盐类水解的原理,正确的判断出盐溶液的酸碱性是解题的关键。

(14分)已知硝酸锏溶液颜色为蓝色.某学校化学课外小组同学们在做铜与浓硝酸、稀硝酸反应的实验中,发现铜和浓硝酸反应后溶液为绿色旦有红棕色气体产生,而铜和稀硝酸反应后溶液为蓝色,产生无色气体.为弄清反应后溶液颜色出现差异的原因,他们进行了实验探究.
[实验]在两支试管中各放入一小块等质量的铜片,分别加人等体积的浓HN03(14 mol •
L-1)和稀HN03(4mol . L-1 ), 立即用蘸有NaOH的棉花封住试管口。充分反应后铜均无剩余。
(1) Cu与浓HNO3反应的离子方程式________________________________
(2) 用蘸有NaOH的棉花封住试管口的原因________________
已知NO2与NaOH溶液反应中,其中NO2的还原产物是亚硝酸盐(NO2- )
写出反应的化学反应式________________________,
[提出假设]假设一、因为铜离子浓度大造成的。
假设二、溶液呈绿色是因为铜与浓硝酸反应时产生的二氧化氮溶于过量浓硝酸,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色。
[设计实验方案,验证假设]
(3) 上述实验________(“能”或“不能”)证明假设一不成立,原因________________
(4) 甲同学设计实验验证假设二,请帮他完成下表中内容(提示:NO3-在不同条件下的还咬产物较复杂,有时难以观察到气体产生)

[分析推理】
(5)铜和稀硝酸反应后溶液为蓝色的原理________________