网址:http://m.1010jiajiao.com/timu3_id_371026[举报]
在一次学生实验中,学生用带有氧化膜的铝片和稀硫酸反应,发现铝片和稀盐酸、稀硫酸反应发现铝片和稀盐酸反应现象明显,而和稀硫酸几乎不反应.这和“铝能跟稀盐酸或稀硫酸反应生成氢气”不一致,是什么原因呢?是试剂、药品出了问题吗?为了寻找原因,某学生在教师的指导重新用浓盐酸配制了一定浓度的溶液,然后加入0.1×10×10mm3,纯度≥99.5%的铝片验证是否确实存在上述现象,实验结果如下表
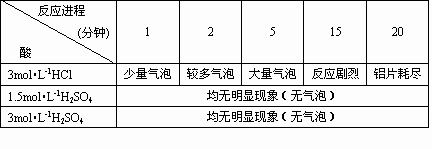
无论是用1.5mol昄-1H2SO4还是用3mol昄-1H2SO4,均无明显现象.其结论还是与“铝能跟稀硫酸或稀盐酸反应生成氢气”不相符合.
问题1:为了探索“铝与稀盐酸和稀硫酸反应的差异原因”,你能对问题的答案作出哪些假设或猜想:
假设一:________
假设二:________……
问题二:为了论证上述假设,你设计的实验方案是:(探究过程)________
结论:________
回答下列问题:
(1)Fe(OH)3胶体呈
| ||
| ||
(2)通过
(3)氢氧化铁胶体能比较稳定存在的原因是
A.胶粒直径小于1nm B.胶粒带正电荷
C.胶粒作布朗运动 D.胶粒能够通过滤纸
Ⅱ(4)用什么方法可以除去淀粉胶体中含有的杂质NaCl溶液?
(5)如何验证(4)中淀粉胶体已经基本净化(写出具体操作步骤)?
实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸的浓度的实验:请完成下列填空:(1)配制100 mL 0.10 mol/L NaOH标准溶液。
①配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、 、 等。
②称量 g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、药匙、 。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用 (填仪器名称)装配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。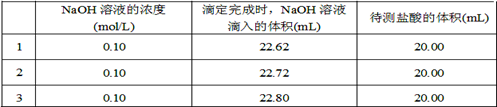
①滴定达到终点的标志是 。
②根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的 ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。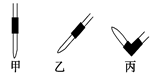
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
| A.滴定终点读数时俯视读数 | B.碱式滴定管尖嘴部分有气泡,滴定后消失 |
| C.锥形瓶水洗后未干燥 | D.称量NaOH固体中混有Na2CO3固体 |
实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸的浓度的实验:请完成下列填空:(1)配制100 mL 0.10 mol/L NaOH标准溶液。
①配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、 、 等。
②称量 g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、药匙、 。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用 (填仪器名称)装配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。

①滴定达到终点的标志是 。
②根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的 ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.滴定终点读数时俯视读数 B.碱式滴定管尖嘴部分有气泡,滴定后消失
C.锥形瓶水洗后未干燥 D.称量NaOH固体中混有Na2CO3固体
E. 酸式滴定管使用前,水洗后未用待测盐酸润洗
查看习题详情和答案>>
 实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③500mL容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)
实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③500mL容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)