题目内容
在一次学生实验中,学生用带有氧化膜的铝片和稀硫酸反应,发现铝片和稀盐酸、稀硫酸反应发现铝片和稀盐酸反应现象明显,而和稀硫酸几乎不反应.这和“铝能跟稀盐酸或稀硫酸反应生成氢气”不一致,是什么原因呢?是试剂、药品出了问题吗?为了寻找原因,某学生在教师的指导重新用浓盐酸配制了一定浓度的溶液,然后加入0.1×10×10mm3,纯度≥99.5%的铝片验证是否确实存在上述现象,实验结果如下表
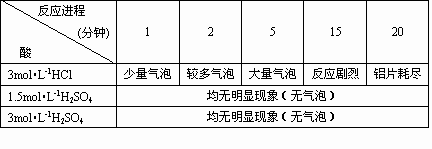
无论是用1.5mol昄-1H2SO4还是用3mol昄-1H2SO4,均无明显现象.其结论还是与“铝能跟稀硫酸或稀盐酸反应生成氢气”不相符合.
问题1:为了探索“铝与稀盐酸和稀硫酸反应的差异原因”,你能对问题的答案作出哪些假设或猜想:
假设一:________
假设二:________……
问题二:为了论证上述假设,你设计的实验方案是:(探究过程)________
结论:________
解析:
假设一:Cl-能促进金属铝表面的氧化膜与H+反应
假设二:SO42-对金属铝表面的氧化膜与H+反应起阻碍作用
问题二:①向3支试管中分别加入5mL1.5mol昄-1H2SO4溶液和已给铝片,向其中一支加入少量的Na2SO4(或K2SO4)晶体,无明显想象(同未加的对比);向另一支试管中加入少量的NaCl(或KCl)晶体,有气泡产生(同未加的对比).
②向2支试管中分别加入5mL3mol昄-1HCl溶液和已给铝片,向其中一支试管中加入少量的Na2SO4(或K2SO4)晶体,气泡立即明显减少(和另一支未加相比)
结论:铝表面的氧化膜,使铝具有一定的耐酸性,这种酸性与H+所处的环境关系很大,即某些阴离子(如Cl-)能促进破坏这种氧化膜,而SO42-却没有这种能力

某学生用已知物质的量浓度的盐酸测定未知物质的/量浓度的NaOH溶液时选择甲基橙作指示剂,请填写下列空白:
(1用标准的盐酸滴定待测的NaOH溶液时:左手_______________________,右手_____________________眼睛注视__________________________________直到因加入一滴盐酸后,溶液由黄色变______色,并且_____________________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是()
A:酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B:滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净但没有干燥
C:酸式滴定管在滴定前有气泡 ,滴定后气泡消失
,滴定后气泡消失
D:读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_____mL终点读数为_______mL,所用盐酸溶液的体积为_________mL
(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH溶液的体积 | 0.1000mol/L盐酸的体积/mL[来源:学+科+网] | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
某学生用已知物质的量浓度的盐酸测定未知物质的量浓度的NaOH溶液时选择甲基橙作指示剂,请填写下列空白:
(1)配制待测液:用含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制500mL溶液。除烧杯、量筒、胶头滴管和玻璃棒外,还需要的玻璃仪器是 。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________。
| A.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净但没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| 滴定次数 | 待测NaOH 溶液的体积来 | 0.1000mol/L盐酸的体积/mL[来源:学+ | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.28 | 26.28 |
| 第二次 | 25.00 | 1.55 | 30.30 | 28.75 |
| 第三次 | 25.00 | 0.20 | 26.42 | 26.22 |
(4)用标准的盐酸滴定上述待测的NaOH溶液时,眼睛要注视锥形瓶中溶液颜色的变化,直到因加入一滴盐酸后,溶液由黄色变________色,并且___________________为止。
某学生用已知物质的量浓度的盐酸测定未知物质的量浓度的NaOH溶液时选择甲基橙作指示剂,请填写下列空白:
(1)配制待测液:用含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制500mL溶液。除烧杯、量筒、胶头滴管和玻璃棒外,还需要的玻璃仪器是 。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________。
A.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净但没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
(3)某学生根据3次实验分别记录有关数据如下表:
|
滴定次数 |
待测NaOH 溶液的体积来 |
0.1000mol/L盐酸的体积/mL[来源:学+ |
||
|
滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
|
第一次 |
25.00 |
0.00 |
26.28 |
26.28 |
|
第二次 |
25.00 |
1.55 |
30.30 |
28.75 |
|
第三次 |
25.00 |
0.20 |
26.42 |
26.22 |
依据上表中有效数据计算该NaOH溶液的物质的量浓度:c(NaOH)=__________。(保留四位有效数字)
(4)用标准的盐酸滴定上述待测的NaOH溶液时,眼睛要注视锥形瓶中溶液颜色的变化,直到因加入一滴盐酸后,溶液由黄色变________色,并且___________________为止。
某学生用已知物质的量浓度的盐酸测定未知物质的量浓度的NaOH溶液时选择甲基橙作指示剂,请填写下列空白:
(1)配制待测液:用含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制500mL溶液。除烧杯、量筒、胶头滴管和玻璃棒外,还需要的玻璃仪器是 。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________。
A.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净但没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
(3)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH 溶液的体积来 | 0.1000mol/L盐酸的体积/mL[学+ | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.28 | 26.28 |
| 第二次 | 25.00 | 1.55 | 30.30 | 28.75 |
| 第三次 | 25.00 | 0.20 | 26.42 | 26.22 |
依据上表中有效数据计算该NaOH溶液的物质的量浓度:c(NaOH)=__________________________。(保留四位有效数字)
(4)用标准的盐酸滴定上述待测的NaOH溶液时,眼睛要注视锥形瓶中溶液颜色的变化,直到因加入一滴盐酸后,溶液由黄色变________色,并且___________________为止。