网址:http://m.1010jiajiao.com/timu3_id_37035[举报]
某同学查阅有关资料,了解到以下相关信息:
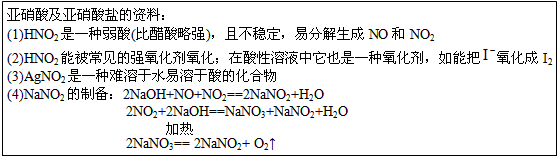
亚硝酸及亚硝酸盐的资料:
(1)HNO2是一种弱酸(比醋酸略强),且不稳定,易分解生成NO和NO2
(2)HNO2能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把氧化成I2
(3)AgNO2种难溶于水易溶于酸的化合物
(4)NaNO2制备:
2NaOH+NO+NO2═2NaNO2+H2O
2NO2+2NaOH═NaNO3+NaNO2+H2O
2NaNO3
| ||
试回答下列问题:
(1)人体正常的血红蛋白中应含Fe2+.若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是
A.亚硝酸盐是还原剂 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐被还原
(2)下列方法中,不能用来区别NaNO2和NaCl的是
A.测定这两种溶液的pH
B.用AgNO3和HNO3两种试剂来区别
C.在酸性条件下加入KI淀粉试液来区别
D.分别在这两种溶液中滴加甲基橙
(3)为了测定某样品中NaNO2的含量,可以使用标准KMnO4溶液进行滴定,试回答:
①KMnO4溶液在滴定过程中作
②若滴定终点读数时目光俯视,则所得结果
(4)某同学在家中欲进行鉴别NaCl与NaNO2的实验,但他家中只有浓醋酸,请问该实验能否成功?说明理由.
(5)现有氮的三种常见氧化物组成的混和气体44.8L(体积已换算成标准状态),其中N2O4、NO体积分数都为20%.
①将该气体通入适量的NaOH溶液中恰好反应,则溶液中NaNO2的质量是
②反应后的溶液蒸干灼烧则NaNO2物质的量
(1)人体正常的血红蛋白中应含Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为
Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________.
A.亚硝酸盐是还原剂 B.维生素C是还原剂 C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐被还原
(2)下列方法中,不能用来区别NaNO2和NaCl的是________.
A.测定这两种溶液的pH
B.用AgNO3和HNO3两种试剂来区别
C.在酸性条件下加入KI淀粉试液来区别
D.分别在这两种溶液中滴加甲基橙
(3)为了测定某样品中NaNO2的含量,可以使用标准KMnO4溶液进行滴定,试回答:
①KMnO4溶液在滴定过程中作________(填“氧化剂” “还原剂”),该滴定过程________(填“要”或“不要”)另加指示剂。
②若滴定终点读数时目光俯视,则所得结果________(填“偏大”“偏小”“无影响”)。
(4)某同学在家中欲进行鉴别NaCl与NaNO2的实验,但他家中只有浓醋酸,请问该实验能否成功?说明理由。_______________________________________
(5)现有氮的三种常见氧化物组成的混和气体44.8L(体积已换算成标准状态),其中N2O4、NO体积分数都为20%。
①将该气体通入适量的NaOH溶液中恰好反应,则溶液中NaNO2的质量是__________g;
②反应后的溶液蒸干灼烧则NaNO2物质的量__________mol。
下列有关实验的说法不正确的是( )
A.淀粉胶体中混有氯化钠杂质,可用半透膜做渗析实验提纯
B.用已被蒸馏水润湿的PH试纸测定未知液的PH时,一定会有误差
C.不用其它试剂即可鉴别稀盐酸和碳酸钠两种无色溶液
D.仅用溴水即可鉴别己烯、苯和四氯化碳
查看习题详情和答案>>A.碘酒 B.青霉素 C.阿司匹林
D.葡萄糖注射液 E.抗酸药(成分为碳酸氢钠)
①上述药品中属于抗生素的是
②能为人体直接提供能量的是
③下列关于药物使用的说法中,正确的是
A.碘酒能使蛋白质变性,常用于外敷消毒
B.长期大量服用阿司匹林可预防疾病,没有毒副作用
C.使用青霉素,可直接静脉注射,不需进行皮肤敏感试验
D.随着平价药房的开设,生病了都可以到药店自己买药服用,不用到医院就诊
(2)某食堂的午餐食谱为:米饭、馒头、烧鱼、烧排骨,该食谱中还应增加是
(3)维生素C是一种重要维生素,能防治坏血病.用淀粉溶液、碘水为试剂,验证维生素C具有还原性的实验操作和现象是
(4)某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其它成分不与盐酸或氢氧化钠反应):
①配制0.100mol?L-1稀盐酸和0.100mol?L-1NaOH溶液
②取一粒药片(0.100g)研碎后加入20.0ml蒸馏水
③加入25.0mL 0.100mol?L-1稀盐酸,搅拌,充分反应
④用0.100mol?L-1NaOH溶液中和剩余的盐酸,用去体积为V ml
请回答下列问题:
为了增加实验的精确性,某同学四次测定的V数据平均为13.00ml,请根据这位同学的实验数据,计算药片中碳酸钙的质量分数为
2013年底,上海青浦发生一家三口误食亚硝酸盐造成两男孩身亡的惨剧。常见的亚硝酸盐主要是亚硝酸钠(NaNO2),它是一种白色不透明晶体,虽然形状很像食盐,而且有咸味,但有毒。亚硝酸钠和氯化钠的部分资料如下表:
|
|
亚硝酸钠(NaNO2) |
氯化钠(NaCl) |
|
水溶性 |
易溶,溶液呈弱碱性 |
易溶,溶液呈中性 |
|
熔点 |
271℃ |
801℃ |
|
沸点 |
320℃会分解 |
1413℃ |
|
跟稀盐酸作用 |
有红棕色的NO2气体放出 |
无反应 |
完成下列填空:
(1)氮元素最外层电子排布式为________,氮原子核外电子共占据了___个轨道。亚硝酸钠中各元素原子半径由大到小依次为_________,亚硝酸的电离方程式为:_______________________。
(2)亚硝酸盐中毒是因为亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,即血红蛋白中的铁元素由二价变为三价,失去携氧能力,使组织出现缺氧现象.美蓝是亚硝酸盐中毒后的有效解毒剂.下列说法不正确的是( )
A.高铁血红蛋白的还原性比亚硝酸盐弱
B.药品美蓝应具有还原性
C.中毒时亚硝酸盐发生还原反应
D.解毒时高铁血红蛋白被还原
(3)NaNO2有毒,将含该物质的废水直接排放会引起水体的严重污染,所以这种废水必须处理后才能排放。处理方法之一:在酸性条件下, NaNO2与KI的物质的量为1:1时恰好完全反应,且I-被氧化为I2,此时产物中含氮的物质(A)为________(填化学式)。若利用上述方法制A,现有两种操作步骤:①先将废水酸化后再加KI;②先将KI酸化后再加入废水。哪种方法较好?____(填序号。假设废水中其它物质不反应)
(4)如要鉴别亚硝酸钠和氯化钠固体,下列方法不可行的是
A.观察并比较它们在水中的溶解速度 B.测定它们各自的熔点
C.在它们的水溶液中滴加甲基橙 D.在酸性条件下加入KI淀粉试液
查看习题详情和答案>>