摘要:如图所示.在直角坐标系的第Ⅱ象限和第Ⅳ象限中的直角三角形区域内.分布着磁感应强度均为B=5.0×10-2T的匀强磁场.方向分别垂直纸面向外和向里.质量为m=6.64×10-27㎏.电荷量为q=+3.2×10-19C的α粒子.由静止开始经加速电压为U=1205V的电场加速后.从坐标点M(-4.)处平行于x轴向右运动.并先后通过匀强磁场区域. ⑴请你求出α粒子在磁场中的运动半径, ⑵请你在图中画出α粒子从直线x=-4到直线 x=4之间的运动轨迹.并在图中标明轨迹与直线 x=4交点的坐标, ⑶求出α粒子在两个磁场区域偏转所用的总时间.
网址:http://m.1010jiajiao.com/timu3_id_370036[举报]
(7分,每空1分)如图所示,已知A元素的最低化合价为-3价,它的最高价氧化物含氧56.21%,原子核内中子数比质子数多1,试用相应元素符号或化学式回答: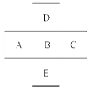
(1)写出它们的元素符号:
A__________,B__________,C___________,D__________。
(2)A、B、C的原子半径由小到大的顺序是________________________________。
(3)A、B、C的最高价氧化物对应水化物的酸性由强到弱的顺序是 ;D、B两元素的气态氢化物稳定性大小顺序是 .
(7分,每空1分)如图所示,已知A元素的最低化合价为-3价,它的最高价氧化物含氧56.21%,原子核内中子数比质子数多1,试用相应元素符号或化学式回答:

(1)写出它们的元素符号:
A__________,B__________,C___________,D__________。
(2)A、B、C的原子半径由小到大的顺序是________________________________。
(3)A、B、C的最高价氧化物对应水化物的酸性由强到弱的顺序是 ;D、B两元素的气态氢化物稳定性大小顺序是 .
查看习题详情和答案>>
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.工业上用合成气(CO、H2)直接或间接制取甲醚.
(1)写出甲醚燃烧的热化学方程式 .
(2)已知H2(g)和C(s)的燃烧热分别是285.8kJ?mol-1、393.5kJ?mol-1;计算反应4C(s)+6H2(g)+O2(g)═2CH2OCH3(g)的反应热为 .
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式为 ;从能量角度分析甲醚用作燃料电池与直接燃烧相比主要的优点是 .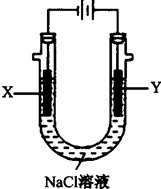
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL滴有酚酞的:NaCl溶液,装置如图所示:
①请写出电解过程中Y电极附近观察到的现象 .
②当燃料电池消耗2.8LO2(标准状况下)时,计算此时:NaCl溶液的pH= (假设溶液的体积不变,气体全部从溶液中逸出).
查看习题详情和答案>>
(1)写出甲醚燃烧的热化学方程式
(2)已知H2(g)和C(s)的燃烧热分别是285.8kJ?mol-1、393.5kJ?mol-1;计算反应4C(s)+6H2(g)+O2(g)═2CH2OCH3(g)的反应热为
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式为

(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL滴有酚酞的:NaCl溶液,装置如图所示:
①请写出电解过程中Y电极附近观察到的现象
②当燃料电池消耗2.8LO2(标准状况下)时,计算此时:NaCl溶液的pH=
(2009?深圳二模)氯碱厂废渣(盐泥)中含有镁钙铁铝的硅酸盐和碳酸盐,其中含镁(以MgO计)约10%,钙(以CaO计)约15%,铁(Ⅱ、Ⅲ)和铝等的含量低于1%.氯碱厂从盐泥中提取MgSO4.7H2O的流程如下:
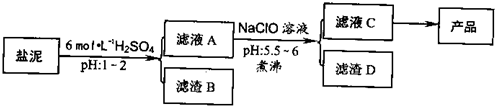
部分阳离子以氢氧化物沉淀时溶液pH
溶解度表
回答下列问题: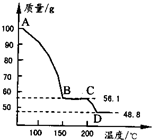
(1)滤渣B的主要成分是:
(2)从滤液A得到滤液C,能否用氨水代替NaClO?
(3)从滤液C中获得产品经过3个操作步骤,分别是
(4)将一定质量的MgSO4.7H2O放在坩埚中加热测得不同温度阶段剩余固体质量如图所示.
据图写出CD段反应的化学方程式
查看习题详情和答案>>

部分阳离子以氢氧化物沉淀时溶液pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 11.2 |
| 温度0C | 10 | 30 | 40 |
| CaSO4 | 0.19 | 0.21 | 0.21 |

(1)滤渣B的主要成分是:
H2SiO3(或H4SO4)\CaSO4(或CaSO4?2H2O)
H2SiO3(或H4SO4)\CaSO4(或CaSO4?2H2O)
.(2)从滤液A得到滤液C,能否用氨水代替NaClO?
否
否
,什么理由氨水不能将Fe2+氧化成Fe3+,则无法沉淀完全
氨水不能将Fe2+氧化成Fe3+,则无法沉淀完全
,其中加热煮沸的目的是加热能使Fe3+和Al3+水解完全,同时因为氢氧化铁和氢氧化铝是胶状沉淀,加热有利于破坏胶体的稳定性,使沉淀颗粒变大利于后面过滤分离
加热能使Fe3+和Al3+水解完全,同时因为氢氧化铁和氢氧化铝是胶状沉淀,加热有利于破坏胶体的稳定性,使沉淀颗粒变大利于后面过滤分离
.(3)从滤液C中获得产品经过3个操作步骤,分别是
加热浓缩
加热浓缩
,冷却结晶
冷却结晶
,过滤
过滤
.(4)将一定质量的MgSO4.7H2O放在坩埚中加热测得不同温度阶段剩余固体质量如图所示.
据图写出CD段反应的化学方程式
MgSO4?H2O
MgSO4+H2O↑
| ||
MgSO4?H2O
MgSO4+H2O↑
.
| ||
 (选做题)
(选做题)按下列要求填空:
(1)将2.8gFe加入稀盐酸中,铁完全反应,在标准状况下,生成H2的体积为
1.12
1.12
L.(2)实验室需配制480mL1mol/LNa2CO3溶液,需要称量Na2CO3的质量是
53.0
53.0
g(精确到0.1g).(3)有O2与HCl组成的混合气体,其质量比是32:73,则O2与HCl的体积比是
1:2
1:2
.(4)相同质量的S02和S03中,所含原子个数比是
15:16
15:16
.(5)与标准状况下VLCO2所含氧原子数目相同的水的质量是
| 45V |
| 28 |
| 45V |
| 28 |
(6)A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种,现利用另一种溶液X,用如图所示的方法可将它们依次确定.
试确定A、B、C、D、X各代表何种溶液.
A:
NaOH
NaOH
,B:NaNO3
NaNO3
,C:Ba(NO3)2
Ba(NO3)2
,D:HNO3
HNO3
,X:MgSO4
MgSO4
.