题目内容
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.工业上用合成气(CO、H2)直接或间接制取甲醚.
(1)写出甲醚燃烧的热化学方程式 .
(2)已知H2(g)和C(s)的燃烧热分别是285.8kJ?mol-1、393.5kJ?mol-1;计算反应4C(s)+6H2(g)+O2(g)═2CH2OCH3(g)的反应热为 .
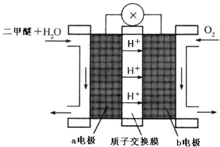
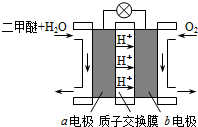
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式为 ;从能量角度分析甲醚用作燃料电池与直接燃烧相比主要的优点是 .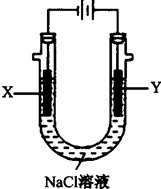
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL滴有酚酞的:NaCl溶液,装置如图所示:
①请写出电解过程中Y电极附近观察到的现象 .
②当燃料电池消耗2.8LO2(标准状况下)时,计算此时:NaCl溶液的pH= (假设溶液的体积不变,气体全部从溶液中逸出).
(1)写出甲醚燃烧的热化学方程式
(2)已知H2(g)和C(s)的燃烧热分别是285.8kJ?mol-1、393.5kJ?mol-1;计算反应4C(s)+6H2(g)+O2(g)═2CH2OCH3(g)的反应热为
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式为

(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL滴有酚酞的:NaCl溶液,装置如图所示:
①请写出电解过程中Y电极附近观察到的现象
②当燃料电池消耗2.8LO2(标准状况下)时,计算此时:NaCl溶液的pH=
分析:(1)依据燃烧热概念含义是1mol甲醚完全燃烧生成稳定氧化物二氧化碳和液态水放出的热量为燃烧热,结合书写方法写出热化学方程式;
(2)依据燃烧热写出热化学方程式,结合盖斯定律计算得到所需热化学方程式和对应焓变;
(3)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,原电池反应比直接燃烧能量转化率高;
(4)①惰性电极电解饱和食盐水,Y电极是阳极,溶液中氯离子失电子生成氯气;
②依据原电池和电解池中存在的电子守恒结合电极反应计算溶液PH;
(2)依据燃烧热写出热化学方程式,结合盖斯定律计算得到所需热化学方程式和对应焓变;
(3)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,原电池反应比直接燃烧能量转化率高;
(4)①惰性电极电解饱和食盐水,Y电极是阳极,溶液中氯离子失电子生成氯气;
②依据原电池和电解池中存在的电子守恒结合电极反应计算溶液PH;
解答:解:(1)甲醚的燃烧热为1455kJ/mol,则燃烧方式的热化学方程式为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;
故答案为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;
(2)H2(g)和C(s)的燃烧热分别是285.8kJ?mol-1、393.5kJ?mol-1;热化学方程式
①H2(g)+
O2(g)=H2O(l)△H=-285.8KJ/mol;
②C(s)+O2(g)=CO2(g)△H=-393.5KJ/mol;
③CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;
依据盖斯定律计算①×3+②×2-③得到反应热化学方程式为:2C(s)+3H2(g)+
O2(g)═CH2OCH3(g):△H=-169.4kJ/mol;
4C(s)+6H2(g)+O2(g)═2CH2OCH3(g):△H=-378.8kJ/mol;
故答案为:△H=-378.8kJ/mol;
(3)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,电极反应式为:CH3OCH3+16OH--12e-=2CO32-+11H2O;从能量角度分析甲醚用作燃料电池与直接燃烧相比主要的优点是能量利用和转化率高;
故答案为:CH3OCH3+16OH-12e-=2CO2-3+11H2O,燃料电池的能量转换效率高;
(4)①电解池中Y电极为阳极,溶液中氯离子失电子发生氧化反应生成氯气,现象是冒气泡,上部溶液呈黄绿色;
故答案为:Y电极附近溶液中有气体产生,上部分呈黄绿色;
②当燃料电池消耗2.8LO2(标准状况下)物质的量=
=0.125mol,电极反应为O2+2H2O+4e-=4OH-,电子转移为0.5mol,电解池中 阳极电极反应为4OH--4e-=2H2O+O2↑,依据电子守恒溶液中减少氢氧根离子物质的量和增加的氢离子物质的量守恒,则溶液中氢离子浓度=
=1mol/L,此时NaCl溶液的pH=14;
故答案为:14;
故答案为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;
(2)H2(g)和C(s)的燃烧热分别是285.8kJ?mol-1、393.5kJ?mol-1;热化学方程式
①H2(g)+
| 1 |
| 2 |
②C(s)+O2(g)=CO2(g)△H=-393.5KJ/mol;
③CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;
依据盖斯定律计算①×3+②×2-③得到反应热化学方程式为:2C(s)+3H2(g)+
| 1 |
| 2 |
4C(s)+6H2(g)+O2(g)═2CH2OCH3(g):△H=-378.8kJ/mol;
故答案为:△H=-378.8kJ/mol;
(3)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,电极反应式为:CH3OCH3+16OH--12e-=2CO32-+11H2O;从能量角度分析甲醚用作燃料电池与直接燃烧相比主要的优点是能量利用和转化率高;
故答案为:CH3OCH3+16OH-12e-=2CO2-3+11H2O,燃料电池的能量转换效率高;
(4)①电解池中Y电极为阳极,溶液中氯离子失电子发生氧化反应生成氯气,现象是冒气泡,上部溶液呈黄绿色;
故答案为:Y电极附近溶液中有气体产生,上部分呈黄绿色;
②当燃料电池消耗2.8LO2(标准状况下)物质的量=
| 2.8L |
| 22.4L/mol |
| 0.5mol |
| 0.5L |
故答案为:14;
点评:本题考查了热化学方程式的书写方法和燃烧热概念,盖斯定律的计算应用,原电池反应、电解池反应原理的应用判断,掌握实质是解题关键,题目难度中等.

练习册系列答案
相关题目

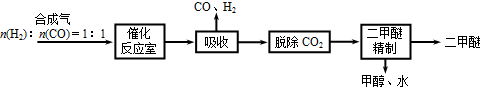
 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应: