摘要:10mol·L-1Na2S2O3溶液滴定.I2+2S2O32-=2I-+S4O62-.消耗了40 mLNa2S2O3溶液.计算: (1)原饱和溶液中Cu(IO3)2的物质的量浓度. (2)若Cu(IO3)2饱和溶液的密度为1.0g·cm-3.室温时Cu(IO3)2的溶解度是多少?
网址:http://m.1010jiajiao.com/timu3_id_369447[举报]
某校化学兴趣小组在加热条件下利用二氧化锰与浓盐酸反应来制取并收集氯气.
(1)写出该反应的离子方程式
(2)若要制取纯净干燥的氯气,应使气体依次通过装有
(3)该小组称取8.7g二氧化锰与足量10mol?L-1的浓盐酸反应,理论上可制得氯气的体积(标准状况)V1=
(4)若该小组量取了10mol?L-1的浓盐酸40mL,与足量的二氧化锰反应,理论上产生氯气的体积为V2(标准状况),则V1
查看习题详情和答案>>
(1)写出该反应的离子方程式
MnO2+4H++2C1-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2C1-
Mn2++Cl2↑+2H2O
.
| ||
(2)若要制取纯净干燥的氯气,应使气体依次通过装有
饱和食盐水
饱和食盐水
和浓硫酸
浓硫酸
的洗气瓶.(3)该小组称取8.7g二氧化锰与足量10mol?L-1的浓盐酸反应,理论上可制得氯气的体积(标准状况)V1=
2.24
2.24
L.(4)若该小组量取了10mol?L-1的浓盐酸40mL,与足量的二氧化锰反应,理论上产生氯气的体积为V2(标准状况),则V1
>
>
V2(填“=”、“>”、“<”).其原因是随着反应进行,反应物浓度减小,反应不再进行
随着反应进行,反应物浓度减小,反应不再进行
(不考虑装置的气密性及浓盐酸的挥发). (2010?浙江)已知:
(2010?浙江)已知:①25℃时弱电解质电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Ksp(CaF2)=1.5×10-10
②25℃时,2.0×10-3mol?L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如图所示:
请根据以下信息回答下旬问题:
(1)25℃时,将20mL 0.10mol?L-1CH3COOH溶液和20mL 0.10mol?L-1HSCN溶液分别与20mL 0.10mol?L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为:

反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是
HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反映速率较快
HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反映速率较快
,反应结束后所得两溶液中,c(CH3COO-)<
<
c(SCN-)(填“>”、“<”或“=”)(2)25℃时,HF电离平衡常数的数值Ka≈
3.5×10-4
3.5×10-4
,列式并说明得出该常数的理由Ka(HF)=
,当c(F-)和c(HF)相等时,Ka(HF)=c(H+),查图中的交点处即为c(F-)=c(HF),故所对应的pH即为Ka(HF)的负对数
| c(H+)?c(F-) |
| c(HF) |
Ka(HF)=
,当c(F-)和c(HF)相等时,Ka(HF)=c(H+),查图中的交点处即为c(F-)=c(HF),故所对应的pH即为Ka(HF)的负对数
.| c(H+)?c(F-) |
| c(HF) |
(3)4.0×10-3mol?L-1HF溶液与4.0×10-4 mol?L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生.
 将 0.10mol/L酸逐渐加入到 V mL 0.10mol/L的碱溶液中时,混合溶液的pH变化关系如图所示.下列组合中能正确表示如图图示关系的是( ) 将 0.10mol/L酸逐渐加入到 V mL 0.10mol/L的碱溶液中时,混合溶液的pH变化关系如图所示.下列组合中能正确表示如图图示关系的是( )
|
查看习题详情和答案>>
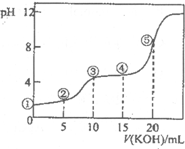 常温下,用0.10mol?L-1 KOH溶液滴定10.00ml 0.10mol?L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )
常温下,用0.10mol?L-1 KOH溶液滴定10.00ml 0.10mol?L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是( )