网址:http://m.1010jiajiao.com/timu3_id_369398[举报]
为测定一置于空气中的某硫酸酸化的FeSO4溶液中的Fe2+被氧化的百分率,某同学准确量取pH=1(忽略Fe2+、Fe3+的水解)的FeSO4溶液200 mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀27.96 g;再另取同样的FeSO4溶液200 mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0 g。
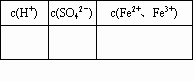
(1)计算该FeSO4溶液中各离子的物质的量浓度并填写下表:
| c( H+)/mol-1 | c( SO42-)/mol-1 | c(Fe2+、Fe3+)/mol-1 |
注:表示Fe2+和Fe3+的总的物质的量浓度
(2)计算原溶液中Fe2+被氧化的百分率。
查看习题详情和答案>>(1)通过计算,填写下表
c(H+) | c( | c(Fe2+、Fe3+) |
|
|
|
注:c(Fe2+、Fe3+)表示Fe2+和Fe3+的总的物质的量的浓度。
(2)计算原溶液中Fe2+被氧化的百分率。
(3)当Fe2+部分被氧化时,试推导c(Fe2+)、c(Fe3+)与c(H+)、c(![]() )的关系。
)的关系。
| |||||||||||||||
(14分)为测定一置于空气中的某硫酸酸化的FeS04溶液中Fe2+被氧化的百分率,某同学准确量取pH=l(忽略Fe2+、Fe3+的水解)的FeS04溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀28.0g;再另取同样的FeS04溶液200mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0g。
(1)通过计算,填写下表:
| C(H+) | C(SO42—) | C(Fe2+、Fe3+) |
| | | |
(2)计算原溶液中Fe2+被氧化的百分率。
(3)当Fe2+部分被氧化时,试推导c(Fe2+、Fe3+)与c(H+)、c(SO42—)的关系。 查看习题详情和答案>>
(14分)为测定一置于空气中的某硫酸酸化的FeS04溶液中Fe2+被氧化的百分率,某同学准确量取pH=l(忽略Fe2+、Fe3+的水解)的FeS04溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀28.0g;再另取同样的FeS04溶液200mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0g。
(1)通过计算,填写下表:
|
C(H+) |
C(SO42—) |
C(Fe2+、Fe3+) |
|
|
|
|
注:c(Fe2+、Fe3+)表示Fe2+和Fe3+的总的物质的量的浓度
(2)计算原溶液中Fe2+被氧化的百分率。
(3)当Fe2+部分被氧化时,试推导c(Fe2+、Fe3+)与c(H+)、c(SO42—)的关系。
查看习题详情和答案>>