��Ŀ����
Ϊ�ⶨһ���ڿ����е�ij�����ữ��FeSO4��Һ�е�Fe2+�������İٷ��ʣ�ijͬѧȷ��ȡpH=1(����Fe2+��Fe3+��ˮ��)��FeSO4��Һ200 mL���������BaCl2��Һ����ַ�Ӧ����ˡ�ϴ�ӡ�����õ�����27.96 g������ȡͬ����FeSO4��Һ200 mL�������м������NaOH��Һ������ʹ���ַ�Ӧ��������ȫ����Ϊ���ɫ���ˡ�ϴ�Ӳ��������ù��壬���յù���8.0 g��
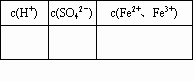
(1)�����FeSO4��Һ�и����ӵ����ʵ���Ũ�Ȳ���д�±���
| c( H+)/mol-1 | c( SO42-)/mol-1 | c(Fe2+��Fe3+)/mol-1 |
ע����ʾFe2+��Fe3+���ܵ����ʵ���Ũ��
(2)����ԭ��Һ��Fe2+�������İٷ��ʡ�
(1)
| c( H+)/mol-1 | c( SO42-)/mol-1 | c(Fe2+��Fe3+)/mol-1 |
| 0.1 | 0.6 | 0.5 |
(2)���ݵ���غ��У�
2?c(Fe2+)+3?c(Fe3+)+c(H+)=2?c(SO42��)
����(1)���������ݣ�
2?c(Fe2+)+3?c(Fe3+)=1.1 mol?L-1
��c(Fe2+)+c(Fe3+)=0.5 mol?L-1
��ã�c(Fe2+)=0.4 mol?L-1��c(Fe3+)=0.1 mol?L-1
Fe2+�������İٷ���Ϊ��![]() ��100%=20%
��100%=20%

| |||||||||||||||
(14��)Ϊ�ⶨһ���ڿ����е�ij�����ữ��FeS04��Һ��Fe2+�������İٷ��ʣ�ijͬѧȷ��ȡpH=l(����Fe2+��Fe3+��ˮ��)��FeS04��Һ200mL���������BaCl2��Һ����ַ�Ӧ����ˡ�ϴ�ӡ�����õ�����28.0g������ȡͬ����FeS04��Һ200mL�������м������NaOH��Һ������ʹ���ַ�Ӧ��������ȫ����Ϊ���ɫ���ˡ�ϴ�Ӳ��������ù��壬���յù���8.0g��
(1)ͨ�����㣬��д�±���
| C(H+) | C(SO42��) | C(Fe2+��Fe3+) |
| | | |
(2)����ԭ��Һ��Fe2+�������İٷ��ʡ�
(3)��Fe2+���ֱ�����ʱ�����Ƶ�c(Fe2+��Fe3+)��c(H+)��c(SO42��)�Ĺ�ϵ��
(14��)Ϊ�ⶨһ���ڿ����е�ij�����ữ��FeS04��Һ��Fe2+�������İٷ��ʣ�ijͬѧȷ��ȡpH=l(����Fe2+��Fe3+��ˮ��)��FeS04��Һ200mL���������BaCl2��Һ����ַ�Ӧ����ˡ�ϴ�ӡ�����õ�����28.0g������ȡͬ����FeS04��Һ200mL�������м������NaOH��Һ������ʹ���ַ�Ӧ��������ȫ����Ϊ���ɫ���ˡ�ϴ�Ӳ��������ù��壬���յù���8.0g��
(1)ͨ�����㣬��д�±���
|
C(H+) |
C(SO42��) |
C(Fe2+��Fe3+) |
|
|
|
|
ע��c(Fe2+��Fe3+)��ʾFe2+��Fe3+���ܵ����ʵ�����Ũ��
(2)����ԭ��Һ��Fe2+�������İٷ��ʡ�
(3)��Fe2+���ֱ�����ʱ�����Ƶ�c(Fe2+��Fe3+)��c(H+)��c(SO42��)�Ĺ�ϵ��
��1��ͨ�����㣬��д�±�
c��H+�� | c�� | c��Fe2+��Fe3+�� |
|
|
|
ע��c��Fe2+��Fe3+����ʾFe2+��Fe3+���ܵ����ʵ�����Ũ�ȡ�
��2������ԭ��Һ��Fe2+�������İٷ��ʡ�
��3����Fe2+���ֱ�����ʱ�����Ƶ�c(Fe2+)��c��Fe3+����c(H+)��c(![]() )�Ĺ�ϵ��
)�Ĺ�ϵ��