摘要:下列有关说法正确的是 A.胶体能够较稳定存在的根本原因是胶粒作布朗运动 B.铝丝和铜丝用导线连接后插入冷的浓硝酸溶液中构成原电池.铝为负极 C.氯化钠投入到酒精中将形成胶体 D.蛋白质溶液中加入氯化汞溶液能使其发生盐析
网址:http://m.1010jiajiao.com/timu3_id_368482[举报]
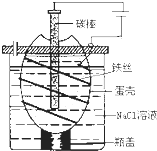 工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,(1)写出电解饱和氯化钠溶液时,总离子反应方程式:
2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
2Cl-+2H2O
Cl2↑+H2↑+2OH-
.
| ||
(2)下列有关说法正确的是
A.电解一段时间后,往蛋壳内溶液中滴加几滴
紫色石蕊试液,先变红后又褪色
B.蛋壳表面缠绕铁丝发生氧化反应
C.为增强导电性,可将石墨棒换成铜电极
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
(3)电解200mL 0.5mol/L的NaCl溶液,在标准状况下,阴极收集到2.24L气体时,
阳极产生的气体为
1.68
1.68
L,常温下,若将电解后的溶液稀释至1L,则溶液的pH约为13
13
;若将阳极生成的气体通入电解后的溶液中,反应的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O
Cl2+2OH-═Cl-+ClO-+H2O
,充分反应后,则所得溶液中阴离子的浓度由大到小依次是C(Cl-)>C(ClO-)>C(OH-)
C(Cl-)>C(ClO-)>C(OH-)
.(4)若将电解后阳极所产生的气体全部通入1mol/L 500mL Na2SO3的溶液中,使之充分反应(假设溶液的体积变化忽略不计),则所得溶液中SO42-的物质的量浓度最多为
0.2
0.2
mol/L.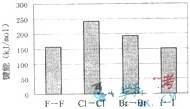 (2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.
(2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.(1)在光照条件下.氯气和氢气反应过程如下:
①Cl2→Cl+Cl ②Cl+H2→HCl+H ③H+Cl2→HCl+Cl …
反应②中形成的化合物的电子式为


非极性
非极性
键(填“极性”或“非极性”).(2)在短周期主族元素中,氯元素及与其相邻元素的原予半径从大到小的顺序是
S>Cl>F
S>Cl>F
.(用元素符号表示).与氯元素同周期且金属性最强的元素位于周期表的第
三
三
周期IA
IA
族.(3)卤索单质及化合物在许多性质上都存在着递变规律.下列有关说法正确的是
a
a
.a.卤化银的颜色按AgCl、AgBr、AgI的顺序依次加深
b?卤化氢的键长按H-F、H-Cl、H-Br、H-I的顺序依次减小
c?卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
d?卤索单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
(4)卤素单质的键能大小如图.由图推断:
①非金属性强的卤素,其单质分子的化学键
不一定容易
不一定容易
断裂(填“容易”或“不容易”或“不一定容易”).②卤素单质键能大小与键长的关系为:
除F2外.键长增大,键能减小
除F2外.键长增大,键能减小
. (2012?绵阳模拟)钾在氧气中燃烧时得到一种钾的氧化物晶体,其结构如图所示,下列有关说法正确的是( )
(2012?绵阳模拟)钾在氧气中燃烧时得到一种钾的氧化物晶体,其结构如图所示,下列有关说法正确的是( )