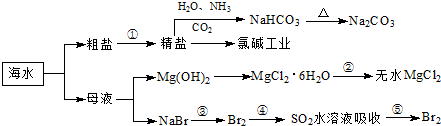
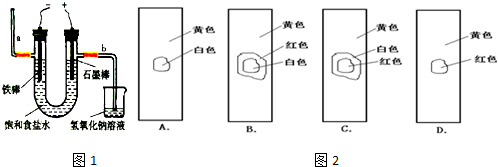
题目内容
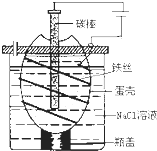 工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,(1)写出电解饱和氯化钠溶液时,总离子反应方程式:
2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
2Cl-+2H2O
Cl2↑+H2↑+2OH-
.
| ||
(2)下列有关说法正确的是
A.电解一段时间后,往蛋壳内溶液中滴加几滴
紫色石蕊试液,先变红后又褪色
B.蛋壳表面缠绕铁丝发生氧化反应
C.为增强导电性,可将石墨棒换成铜电极
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
(3)电解200mL 0.5mol/L的NaCl溶液,在标准状况下,阴极收集到2.24L气体时,
阳极产生的气体为
1.68
1.68
L,常温下,若将电解后的溶液稀释至1L,则溶液的pH约为13
13
;若将阳极生成的气体通入电解后的溶液中,反应的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O
Cl2+2OH-═Cl-+ClO-+H2O
,充分反应后,则所得溶液中阴离子的浓度由大到小依次是C(Cl-)>C(ClO-)>C(OH-)
C(Cl-)>C(ClO-)>C(OH-)
.(4)若将电解后阳极所产生的气体全部通入1mol/L 500mL Na2SO3的溶液中,使之充分反应(假设溶液的体积变化忽略不计),则所得溶液中SO42-的物质的量浓度最多为
0.2
0.2
mol/L.分析:(1)电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电;
(2)A.电解时,阴极附近生成氢氧化钠,阳极上生成氯气,氯气和氢氧化钠反应生成次氯酸钠,次氯酸有漂白性;
B.铁丝作阴极,阴极上发生还原反应;
C.当铜棒作阳极,阳极上铜失电子发生氧化反应;
D.鸡蛋壳有隔离作用;
(3)根据电解方程式计算阳极上产物的体积,根据氢气和氢氧根离子之间的关系式计算溶液中氢氧根离子浓度,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,氯化钠是强酸强碱盐,次氯酸钠是弱酸弱碱盐,所以其溶液呈碱性;
(4)根据转移电子守恒计算.
(2)A.电解时,阴极附近生成氢氧化钠,阳极上生成氯气,氯气和氢氧化钠反应生成次氯酸钠,次氯酸有漂白性;
B.铁丝作阴极,阴极上发生还原反应;
C.当铜棒作阳极,阳极上铜失电子发生氧化反应;
D.鸡蛋壳有隔离作用;
(3)根据电解方程式计算阳极上产物的体积,根据氢气和氢氧根离子之间的关系式计算溶液中氢氧根离子浓度,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,氯化钠是强酸强碱盐,次氯酸钠是弱酸弱碱盐,所以其溶液呈碱性;
(4)根据转移电子守恒计算.
解答:解:(1)电解饱和食盐水时,阳极上氯离子放电,阴极上氢离子放电,同时溶液中生成氢氧化钠,所以电池反应式为:2Cl-+2H2O
Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-;
(2)A.电解时,阳极上生成氯气,阴极上析出氢气,氯气和水反应生成次氯酸,次氯酸有漂白性,所以往蛋壳内溶液中滴加几滴紫色石蕊试液,先变红后又褪色,故正确;
B.蛋壳表面缠绕铁丝作阴极,阴极上得电子发生还原反应,故错误;
C.将石墨棒换成铜电极,阳极上铜失电子生成铜离子,所以阳极上得不到氯气,故错误;
D.氯气在石墨棒上生成,氢气在铁丝上生成,所以蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触,故正确;
故选AD;
(3)电解200mL 0.5mol/L的NaCl溶液,在标准状况下,阴极收集到2.24L气体时,转移电子的物质的量=
mol×2=0.2mol,氯离子完全放电时,转移电子的物质的量=0.5mol/L×0.2L=0.1mol,还有0.1mol电子是氢氧根离子失去的电子,所以生成氧气的体积=
×22.4L/mol=0.56L,生成氯气的体积=
×22.4L/mol=1.12L,所以阳极上生成气体体积为(0.56+1.12)L=1.68L;
2Cl-+2H2O
Cl2↑+H2↑+2OH-知,在标准状况下,阴极收集到2.24L气体时,生成氢氧化钠的物质的量为
mol×
×2=0.1mol,则氢氧化钠的物质的量浓度=
=0.1mol/L,则溶液的pH=13,
阳极上生成氯气,氯气和氢氧化钠反应生成氯化钠和次氯酸钠,离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,
氯化钠是强酸强碱盐不水解,次氯酸钠是强碱弱酸盐,易水解,所以溶液中离子浓度大小是 C(Cl-)>C (ClO-)>C( OH-),
故答案为:1.68,13,Cl2+2OH-═Cl-+ClO-+H2O,C(Cl-)>C (ClO-)>C( OH-);
(4)氯气和氧气具有强氧化性,能和亚硫酸钠发生氧化还原反应生成硫酸钠,在标准状况下,阴极收集到2.24L气体时转移电子的物质的量=0.2mol,当有0.2mol电子转移时,生成硫酸根离子的物质的量=
=0.1mol,则硫酸根离子的浓度=
=0.2mol/L,
故答案为:0.2.
| ||
故答案为:2Cl-+2H2O
| ||
(2)A.电解时,阳极上生成氯气,阴极上析出氢气,氯气和水反应生成次氯酸,次氯酸有漂白性,所以往蛋壳内溶液中滴加几滴紫色石蕊试液,先变红后又褪色,故正确;
B.蛋壳表面缠绕铁丝作阴极,阴极上得电子发生还原反应,故错误;
C.将石墨棒换成铜电极,阳极上铜失电子生成铜离子,所以阳极上得不到氯气,故错误;
D.氯气在石墨棒上生成,氢气在铁丝上生成,所以蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触,故正确;
故选AD;
(3)电解200mL 0.5mol/L的NaCl溶液,在标准状况下,阴极收集到2.24L气体时,转移电子的物质的量=
| 2.24 |
| 22.4 |
| 0.2mol-0.1mol |
| 4 |
| 0.1mol |
| 2 |
2Cl-+2H2O
| ||
| 2.24 |
| 22.4 |
| 1 |
| 2 |
| 0.1mol |
| 1L |
阳极上生成氯气,氯气和氢氧化钠反应生成氯化钠和次氯酸钠,离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,
氯化钠是强酸强碱盐不水解,次氯酸钠是强碱弱酸盐,易水解,所以溶液中离子浓度大小是 C(Cl-)>C (ClO-)>C( OH-),
故答案为:1.68,13,Cl2+2OH-═Cl-+ClO-+H2O,C(Cl-)>C (ClO-)>C( OH-);
(4)氯气和氧气具有强氧化性,能和亚硫酸钠发生氧化还原反应生成硫酸钠,在标准状况下,阴极收集到2.24L气体时转移电子的物质的量=0.2mol,当有0.2mol电子转移时,生成硫酸根离子的物质的量=
| 0.2mol |
| 2 |
| 0.1mol |
| 0.5L |
故答案为:0.2.
点评:本题考查了电解池原理,难点是(3)题中阳极上不仅有氯离子放电,还有氢氧根离子放电,很多学生往往漏掉氢氧根离子放电而出现错误,为易错点.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。
(1)若采用无隔膜法电解冷的食盐水时,Cl2会与NaOH充分接触,导致产物仅是NaClO和H2。无隔膜法电解冷的食盐水相应的离子方程式为 。
(2)氯碱工业耗能高,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。

①经精制的饱和NaCl溶液应从图中电解池的 (填写“左” 或“右”)池注入。
②图中X是____ __(填化学式);乙中右室的电极反应式为: _ ,图示中氢氧化钠溶液质量分数a%与b%的关系是 (填字母)。
A. a%=b% B. a%﹥b% C. a%﹤b%
③甲中的离子交换膜为 (填“阳离子交换膜”或“阴离子交换膜”)。
(3)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol/L的4种钠盐溶液pH如下表:
|
溶质 |
Na2CO3 |
NaHCO3 |
NaClO |
NaHSO3 |
|
pH |
11.6 |
9.7 |
10.3 |
5.2 |
下列说法中,不正确的是 (填字母)
a.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
b.四种溶液中,水的电离程度最大的是NaClO
c.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
d.NaHSO3溶液中离子浓度大小顺序为c(Na+)> c(H+)>c(HSO3-) >c(SO32-)>c(OH-)