摘要:分析:从反应:固体甲+溶液C®溶液B+氢气.可知.固体甲为一金属单质.在金属活动顺序中排在氢之前,溶液C为一酸溶液,溶液B为一盐溶液.其中必然含有金属甲的阳离子和酸C中的酸根离子.根据题目可以得出固体甲为铁粉.溶液C为硫酸.溶液B为硫酸亚铁溶液.再根据反应:固体甲+溶液A®固体乙+溶液B.可知.金属铁与溶液A反应生成固体乙和硫酸亚铁溶液.由盐的性质可以得出.此反应为金属与盐的反应.则溶液A为硫酸铜溶液.生成的固体乙为金属铜.根据反应:固体丙+溶液C®溶液A+水.可知.固体丙与硫酸反应生成硫酸铜溶液和水.由酸的性质可知此固体应为碱性氧化物.则固体丙为氧化铜.
网址:http://m.1010jiajiao.com/timu3_id_3677[举报]
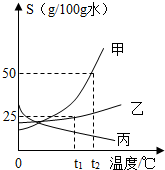 (2013?奉贤区二模)甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
(2013?奉贤区二模)甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:(1)t1℃时,甲的溶解度
>
>
乙的溶解度.(填“>”、“<”或“=”)(2)t1℃时,将20g乙固体加入到50g水中,充分搅拌后,所得溶液的质量为
62.5
62.5
g.(3)现有操作步骤:a.溶解 b.过滤 c.降温结晶 d.加热浓缩;若甲固体中含有少量乙,则提纯甲的操作步骤是
adcb
adcb
(填字母序号).(4)将丙物质的不饱和溶液变为饱和溶液.下列说法正确的是
Ⅲ、Ⅳ
Ⅲ、Ⅳ
(填字母序号).Ⅰ.溶质的质量一定不变Ⅱ.溶质的质量分数一定增大
Ⅲ.溶液质量可能不变Ⅳ.可升高温度或蒸发溶剂
(5)向100g t2℃的水中加入55g甲固体,发现全部溶解,一段时间后又有部分甲的晶体析出.你认为“全部溶解”的原因可能是
固体甲溶于水时放热
固体甲溶于水时放热
.(2004?眉山一模)实验室把氯酸钾和二氧化锰的混合物30g装入大试管,加热制氧气.待反应完全后,冷却,称得固体残留物的质量为20.4g.求:
(1)制得氧气的质量是多少?
(2)原混合物氯酸钾的质量是多少?
(3)若把该反应的固体残留物溶于水中,滤去不溶物后,取该滤液质量的1/10,与34g硝酸银溶液恰好完全反应,求该硝酸银溶液的溶质质量分数.
查看习题详情和答案>>
(1)制得氧气的质量是多少?
(2)原混合物氯酸钾的质量是多少?
(3)若把该反应的固体残留物溶于水中,滤去不溶物后,取该滤液质量的1/10,与34g硝酸银溶液恰好完全反应,求该硝酸银溶液的溶质质量分数.
实验室把氯酸钾和二氧化锰的混合物30g装入大试管,加热制氧气.待反应完全后,冷却,称得固体残留物的质量为20.4g.求:
(1)制得氧气的质量是多少?
(2)原混合物氯酸钾的质量是多少?
(3)若把该反应的固体残留物溶于水中,滤去不溶物后,取该滤液质量的1/10,与34g硝酸银溶液恰好完全反应,求该硝酸银溶液的溶质质量分数.
查看习题详情和答案>>
(1)制得氧气的质量是多少?
(2)原混合物氯酸钾的质量是多少?
(3)若把该反应的固体残留物溶于水中,滤去不溶物后,取该滤液质量的1/10,与34g硝酸银溶液恰好完全反应,求该硝酸银溶液的溶质质量分数.
查看习题详情和答案>>