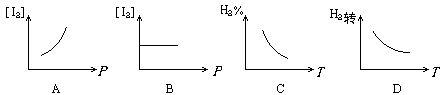
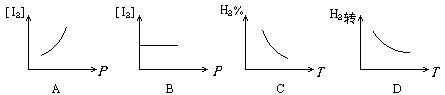
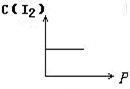
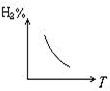
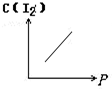摘要:3.对于化学平衡的有关图象问题.可按以下的方法进行分析: (1)认清坐标系.搞清纵.横坐标所代表的意义.并与勒沙特列原理挂钩. (2)紧扣可逆反应的特征.搞清正反应方向是吸热还是放热.体积增大还是减小.不变.有无固体.纯液体物质参加或生成等. (3)看清速率的变化及变化量的大小.在条件与变化之间搭桥. (4)看清起点.拐点.终点.看清曲线的变化趋势. (5)先拐先平.例如.在转化率-时间图上.先出现拐点的曲线先达到平衡.此时逆向推理可得该变化的温度高.浓度大.压强高. (6)定一议二.当图象中有三个量时.先确定一个量不变再讨论另外两个量的关系. 例1 下图Ⅰ.Ⅱ.Ⅲ分别代表反应①③.②.④.则Y轴是指 ①N2(g)+3H2(g) 2NH3(g);△H=-Q ②H2(g)+I2(g) 2HI(g); △H=+Q ③CO(g)+2H2(g) CH3OH(g); △H=-Q ④2SO3(g)2 2SO2(g)+O2(g); △H=+Q A.平衡混合气中一种生成物的百分含量 B.平衡混合气中一种反应物的百分含量 C.平衡混合气中一种生成物的转化率 D.平衡混合气中一种反应物的转化率 解析 该题要求能够运用勒沙特列原理迅速逆向思维.当压强增大时.①③的平衡均右移.而Ⅰ曲线为增大趋势.符合题意,②所对应的Ⅱ曲线无变化.平衡不移动故与该题的解无关,④在增大压强时平衡逆向移动.Ⅲ曲线为减小趋势.符合题意.所以.答案为AD. 例2 由可逆反应测绘出图象如下图.纵坐标为生成物在平衡混合物中的百分含量.下列对该反应的判断正确的是 A.反应物中一定有气体 B.生成物中一定有气体 C.正反应一定是放热反应 D.正反应一定是吸热反应 解析 定一议二.温度不变时.增大压强.生成物的百分含量降低.说明平衡逆向移动.逆向为体积缩小方向.而题中未给出具体的可逆反应.但是可以确定生成物中一定有气体,压强不变时.升高温度.生成物的百分含量增大.说明平衡正向移动.正向为吸热反应,所以答案为BD. [能力突破训练]
网址:http://m.1010jiajiao.com/timu3_id_36746[举报]
某化学研究小组探究外界条件对化学反应mA(g)+nB(g)?pC(g)的速率和平衡的影响图象如下,下列判断正确的是( )
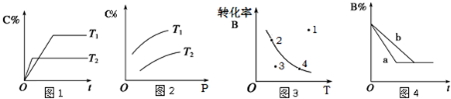

| A、由图1可知,T1<T2,该反应正反应为吸热反应 | B、由图2可知,该反应m+n<p | C、图3中,表示反应速率v正>v逆的是点3 | D、图4中,若m+n=p,则a曲线一定使用了催化剂 |