题目内容
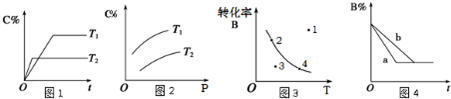
| A、由图1可知,T1<T2,该反应正反应为吸热反应 | B、由图2可知,该反应m+n<p | C、图3中,表示反应速率v正>v逆的是点3 | D、图4中,若m+n=p,则a曲线一定使用了催化剂 |
B.图2说明增大压强,C在反应混合物中的体积分数(ф)增大,说明增大压强平衡向正反应方向移动;
C.在曲线上,当温度一定时,B的转化率也一定,故曲线上任意一点都表示达到平衡状态,而曲线外的任意一点都表示未达平衡状态.在曲线下方的任意一点,要想达到同温度下的平衡状态,即向上引垂直线到曲线上的一点,这样B的转化率要增大,平衡向右移动,在曲线上方的任意一点,要想达到同温度下的平衡状态,即向下引垂直线到曲线上的一点,这样B的转化率要减小,平衡向左移动,据此解答;
D.催化剂不影响化学平衡,能改变反应速率,反应前后气体的物质的量不变的反应,增大压强,正、逆速率都同等程度增大,到达平衡时间短,不影响平衡.
B.由图2图象可以看出,在同一温度下,增大压强,C在反应混合物中的体积分数(ф)增大,说明增大压强平衡向正反应方向移动,说明正反应为体积缩小的反应,即m+n>p,故B错误;
C.在曲线上,当温度一定时,B的转化率也一定,曲线上任意一点都表示达到平衡状态,所以2、4处于平衡状态,v(正)=v(逆),点1在曲线上方,未达到平衡状态,要想达到同温度下的平衡状态,即由点1向下引垂直线到曲线上的一点,这样B的转化率要减小,平衡向左移动,故v(正)<v(逆),点3在曲线下方,未达到平衡状态,要想达到同温度下的平衡状态,即由点3向上引垂直线到曲线上的一点,这样B的转化率要增大,平衡向右移动,故v(正)>v(逆),故C正确;
D.甲的时间短,反应速率快,催化剂只改变化学反应速率不影响化学平衡,可能为使用了催化剂,但m+n=p,说明反应前后气体的物质的量不变,增大压强,正、逆速率都同等程度增大,到达平衡时间短,不影响平衡,所以a曲线也可能是增大压强,故D错误.
故选C.

探究银镜反应的最佳实验条件(部分实验数据如下表):
实验变量 实验序号 | 银氨溶液的量(mL) | 乙醛的量(滴) | 水浴温度(℃) | 反应混合液的pH | 出现银镜时间(min) |
实验1 | 1 | 3 | 65 | 11 | 5 |
实验2 | 1 | 3 | 45 | 11 | 6.5 |
实验3 | 1 | 5 | 65 | 11 | 4 |
实验4 | 1 | 3 | 30 | 11 | 9 |
实验5 | 1 | 3 | 50 | 11 | 6 |
实验6 | 1 | 5 | 80 | 11 | 3 |
请回答下列问题:
(1)若只进行实验1和实验3,其探究目的是____________________。
(2)当银氨溶液的量为1 mL,乙醛的量为3滴,水浴温度为
(3)若还要探究银氨溶液的用量对出现银镜快慢的影响,如何进行实验?__________________
某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究。
[实验一] 取样品0. 100 g,用右图所示实验装置进行测定。
(夹持装置省略)
(1)检查装置A气密性的方法是 。
(2)若在实验过程中共产生气体11.20 mL(已折算成标准
状况),则样品中Na2O2的纯度为 。
[实验二] 样品溶于水后用盐酸滴定
(3)取一定量样品溶于水并配制成250 mL溶液,配制时,所用到的玻璃仪器除了烧杯和玻璃棒外,还需用到 。
(4)取上述所配溶液各25.00 mL,用一定浓度的标准盐酸滴定,平行实验记录如下表:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 标准盐酸体积(mL) | 23.00 | 24.98 | 25.00 | 25.02 |
由表中数据可知,标准盐酸体积的平均值为 mL。若滴定前用上述所配溶液润洗锥形瓶,对实验测定结果产生的影响是 (填“偏高”、“偏低”或“无影响”)。
[实验分析] 实验结果对比分析
(5)小组同学对比两个实验发现,实验一测得的Na2O2样品的纯度比理论值明显偏小。经过分析,小组同学认为,明显偏差不是由操作失误和装置缺陷引起的,可能是反应原理上的原因。查阅资料发现:Na2O2与水反应产生的H2O2未完全分解。
①写出Na2O2与水生成H2O2的化学方程式 。
②若将实验一稍加改进,就能使测定结果接近理论值,写出改进方案:
。
某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究。
[实验一] 取样品0. 100 g,用右图所示实验装置进行测定。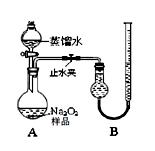
(夹持装置省略)
(1)检查装置A气密性的方法是 。
(2)若在实验过程中共产生气体11.20 mL(已折算成标准
状况),则样品中Na2O2的纯度为 。
[实验二] 样 品溶于水后用盐酸滴定
品溶于水后用盐酸滴定
(3)取一定量样品溶于水并配制成250 mL溶液,配制时,所用到的玻璃仪器除了烧杯和玻璃棒外,还需用到 。
(4)取上述所配溶液各25.00 mL,用一定浓度的标准盐酸滴定,平行实验记录如下表:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 标准盐酸体积(mL) | 23.00 | 24.98 | 25.00 | 25.02 |
[实验分析] 实验结果对比分析
(5)小组同学对比两个实验发现,实验一测得的Na2O2样品的纯度比理论值明显偏小。经过分析,小组同学认为,明显偏差不是由操作失误和装置缺陷引起的,可能是反应原理上的原因。查阅资料发现:Na2O2与水反应产生的H2O2未完全分解。
①写出Na2O2与水生成H2O2的化学方程式 。
②若将实验一稍加改进,就能使测定结果接近理论值,写出改进方案:
。
 I.小明对妈妈杀鱼时从鱼肚内取出的鳔(见图)产生了兴趣.他拟定“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅有关资料获知:这种鱼鳔内氧气约占四分之一其余主要为二氧化碳和氮气.探究分两步进行.
I.小明对妈妈杀鱼时从鱼肚内取出的鳔(见图)产生了兴趣.他拟定“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅有关资料获知:这种鱼鳔内氧气约占四分之一其余主要为二氧化碳和氮气.探究分两步进行.
 (2011?宁德一模)某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究.
(2011?宁德一模)某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究.