网址:http://m.1010jiajiao.com/timu3_id_367376[举报]
利用如图所示装置测定中和热的实验步骤如下:
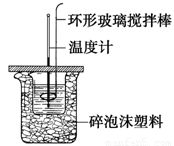
步骤一:用量筒量取50ml 0.50 mol•L-1盐酸倒入小烧杯中,测出盐酸温度t1;
步骤二:用另一量筒量取50ml 0.55 mol•L-1 NaOH溶液,并用另一温度计测出其温度t2;
步骤三:将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度t3。
回答下列问题:
(1)步骤三中倒入NaOH溶液的正确操作是__________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.轻轻地振荡烧杯 B.揭开硬纸片用玻璃棒搅拌
C.用温度计小心搅拌 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)___________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热,理由是________________________________________。
(4)在反应中若因为有放热现象,而造成少量HCl在反应中挥发,则测得的中和热_______(填“偏大”、“偏小”或“不变”)。
查看习题详情和答案>>
利用如图所示装置测定中和热的实验步骤如下: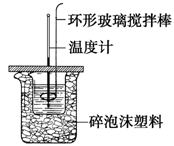
步骤一:用量筒量取50ml 0.50 mol?L-1盐酸倒入小烧杯中,测出盐酸温度t1;
步骤二:用另一量筒量取50ml 0.55 mol?L-1 NaOH溶液,并用另一温度计测出其温度t2;
步骤三:将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度t3。
回答下列问题:
(1)步骤三中倒入NaOH溶液的正确操作是__________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.轻轻地振荡烧杯 B.揭开硬纸片用玻璃棒搅拌
C.用温度计小心搅拌 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)___________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热,理由是________________________________________。
(4)在反应中若因为有放热现象,而造成少量HCl在反应中挥发,则测得的中和热_______(填“偏大”、“偏小”或“不变”)。

步骤一:用量筒量取50ml 0.50 mol?L-1盐酸倒入小烧杯中,测出盐酸温度t1;
步骤二:用另一量筒量取50ml 0.55 mol?L-1 NaOH溶液,并用另一温度计测出其温度t2;
步骤三:将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度t3。
回答下列问题:
(1)步骤三中倒入NaOH溶液的正确操作是__________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.轻轻地振荡烧杯 B.揭开硬纸片用玻璃棒搅拌
C.用温度计小心搅拌 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)___________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热,理由是________________________________________。
(4)在反应中若因为有放热现象,而造成少量HCl在反应中挥发,则测得的中和热_______(填“偏大”、“偏小”或“不变”)。