题目内容
利用如图所示装置测定中和热的实验步骤如下:

步骤一:用量筒量取50ml 0.50 mol?L-1盐酸倒入小烧杯中,测出盐酸温度t1;
步骤二:用另一量筒量取50ml 0.55 mol?L-1 NaOH溶液,并用另一温度计测出其温度t2;
步骤三:将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度t3。
回答下列问题:
(1)步骤三中倒入NaOH溶液的正确操作是__________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.轻轻地振荡烧杯 B.揭开硬纸片用玻璃棒搅拌
C.用温度计小心搅拌 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)___________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热,理由是________________________________________。
(4)在反应中若因为有放热现象,而造成少量HCl在反应中挥发,则测得的中和热_______(填“偏大”、“偏小”或“不变”)。

步骤一:用量筒量取50ml 0.50 mol?L-1盐酸倒入小烧杯中,测出盐酸温度t1;
步骤二:用另一量筒量取50ml 0.55 mol?L-1 NaOH溶液,并用另一温度计测出其温度t2;
步骤三:将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度t3。
回答下列问题:
(1)步骤三中倒入NaOH溶液的正确操作是__________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.轻轻地振荡烧杯 B.揭开硬纸片用玻璃棒搅拌
C.用温度计小心搅拌 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)___________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热,理由是________________________________________。
(4)在反应中若因为有放热现象,而造成少量HCl在反应中挥发,则测得的中和热_______(填“偏大”、“偏小”或“不变”)。
(1)C (2)D
(3)不能, 因为硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响反应的反应热。(4) 偏小
(3)不能, 因为硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响反应的反应热。(4) 偏小
试题分析:(1)在中和热的测定实验中,加热氢氧化钠的次数越多,损失的热量越多。因此步骤三中倒入NaOH溶液的正确操作是一次迅速倒入,答案选C。
(2)A、轻轻地振荡烧杯容易使液体溅出,A不正确;B、揭开硬纸片用玻璃棒搅拌容易使热量损失,B不正确;C、温度计只能测量温度,不能用来搅拌,C不正确;D、用套在温度计上的环形玻璃搅拌棒轻轻地搅动属于正确的操作,D正确,答案选D。
(3)由于硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响反应的反应热,所以不能用Ba(OH)2溶液和硫酸代替NaOH溶液和盐酸测中和热。
(4)在反应中若因为有放热现象,而造成少量HCl在反应中挥发,则导致热量减少,因此测得的中和热偏小。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


 2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
 >
> ,则正反应一定是放热反应
,则正反应一定是放热反应 的转化率大小为:b>a>c
的转化率大小为:b>a>c >
>
 不变时达到平衡,
不变时达到平衡,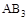 的物质的量大小为:c>b>a
的物质的量大小为:c>b>a