摘要:2.“定 --当一定条件下可逆反应一旦达平衡(可逆反应进行到最大的程度)状态时.在平衡体系的混合物中.各组成成分的含量(即反应物与生成物的物质的量.物质的量浓度.质量分数.体积分数等)保持一定而不变(即不随时间的改变而改变).这是判断体系是否处于化学平衡状态的重要依据.
网址:http://m.1010jiajiao.com/timu3_id_36737[举报]
(2009?湘潭一模)根据下列事实完成下列反应方程式:
(1)AsH3是一种很强的还原剂.室温下,它能在空气中自燃,其氧化产物为As2O3,写出反应的化学方程式:
(2)白磷在一定条件下可被HClO3的水溶液氧化,生成磷的最高价态化合物,而氯元素被还原为最低价态,写出反应化学方程式
(3)稀硫酸与铜不反应,但在稀硫酸中加H2O2后,则可使铜顺利溶解,写出该反应的离子方程式:
(4)在火箭推进器中装有强还原剂(N2H4)和强氧化剂H2O2.当它们混合时,即产生大量氮气和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256.65KJ的热量.写出此反应的热化学方程式:
查看习题详情和答案>>
(1)AsH3是一种很强的还原剂.室温下,它能在空气中自燃,其氧化产物为As2O3,写出反应的化学方程式:
2AsH3+3O2=As2O3+3H2O
2AsH3+3O2=As2O3+3H2O
.(2)白磷在一定条件下可被HClO3的水溶液氧化,生成磷的最高价态化合物,而氯元素被还原为最低价态,写出反应化学方程式
3P4+10HClO3+18H2O=10HCl+12H3PO4
3P4+10HClO3+18H2O=10HCl+12H3PO4
.(3)稀硫酸与铜不反应,但在稀硫酸中加H2O2后,则可使铜顺利溶解,写出该反应的离子方程式:
H2O2+Cu+2H+=Cu2++2H2O
H2O2+Cu+2H+=Cu2++2H2O
.(4)在火箭推进器中装有强还原剂(N2H4)和强氧化剂H2O2.当它们混合时,即产生大量氮气和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256.65KJ的热量.写出此反应的热化学方程式:
N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ?mol-1
N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ?mol-1
.(2013?泰安一模)二氧化碳和纳在一定条件下可制得金刚石,其化学方程式为3CO2+4Na=2X+C(金刚石).设NA为阿伏加德罗常数的值,下列有关此反应的叙述中,不正确的是( )
查看习题详情和答案>>
(附加题)X、Y、Z为常见的三种单质,Z是绿色植物光合作用的产物之一,A、B为常见化合物.它们在一定条件下可发生如图所示的反应(均是在非溶液中进行的反应):

(1)当X为金属,Y为非金属时,A是
(2)当X为非金属,Y为金属时,X可能是
(3)当X与Y均为金属时,X与A反应的化学方程式是
(4)当X与Y均为非金属时,若X与Y同主族,X与A反应的化学方程式是
查看习题详情和答案>>

(1)当X为金属,Y为非金属时,A是
镁
镁
(填名称).(2)当X为非金属,Y为金属时,X可能是
H2
H2
或C
C
(均填化学式).(3)当X与Y均为金属时,X与A反应的化学方程式是
8Al+3Fe3O4
9Fe+4Al2O3(或2Al+Fe2O3
2Fe+Al2O3)
| ||
| ||
8Al+3Fe3O4
9Fe+4Al2O3(或2Al+Fe2O3
2Fe+Al2O3)
.
| ||
| ||
(4)当X与Y均为非金属时,若X与Y同主族,X与A反应的化学方程式是
2C+SiO2
Si+2CO↑
| ||
2C+SiO2
Si+2CO↑
.若X与Y不在同一主族,X与A反应的化学方程式是
| ||
C+H2O
H2+CO
| ||
C+H2O
H2+CO
.
| ||
V、W、X、Y、Z是原子序数依次增大的五种短周期元素,V的原子序数与X的原子序数之和等于Y的原子序数,W的原子序数与X的原子序数之和等于Z的原子序数;V和Y位于同一主族,且Y是一种非金属元素.
(1)比较X、Y、Z的原子半径大小
(2)W与Z形成的单质分别为甲、乙,最简单氢化物分别为丙、丁,下列判断正确的是
a.稳定性:甲>乙,沸点:丙>丁 b.活泼性:甲>乙,沸点:丁>丙
c.稳定性:丙<丁,沸点:甲<乙 d.稳定性:丙>丁,沸点:甲>乙
(3)研究表明:VX2在一定条件下可被还原为晶莹透明的晶体M,其结构中原子的排列为正四面体,请写出M及其2种同素异形体的名称
(4)工业上,将Al2O3、V单质、W单质按物质的量之比1:3:1在高温下反应可制得一种无机非金属材料AlW,该反应的化学方程式为
(5)新型纳米材料ZnFe2Xa可由化合物ZnFe2X4经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
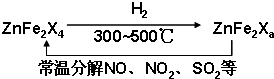
若2mol ZnFe2X a与SO2反应可生成0.75mol S,a=
(6)在t℃时,将a g NH3完全溶于X的常见氢化物,得到V mL溶液,假如该溶液的密度为d g/cm3,质量分数为w,其中含NH4+的物质的量为b mol.下列叙述正确的是
A.溶质的质量分数为w=
B.氨水的物质的量浓度为
mol/L
C.溶液中c(OH-)=
mol?L-+c(H+)
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w.
查看习题详情和答案>>
(1)比较X、Y、Z的原子半径大小
Si
Si
>P
P
>O
O
(填写元素符号);(2)W与Z形成的单质分别为甲、乙,最简单氢化物分别为丙、丁,下列判断正确的是
a
a
a.稳定性:甲>乙,沸点:丙>丁 b.活泼性:甲>乙,沸点:丁>丙
c.稳定性:丙<丁,沸点:甲<乙 d.稳定性:丙>丁,沸点:甲>乙
(3)研究表明:VX2在一定条件下可被还原为晶莹透明的晶体M,其结构中原子的排列为正四面体,请写出M及其2种同素异形体的名称
金刚石
金刚石
、足球烯
足球烯
、石墨
石墨
;(4)工业上,将Al2O3、V单质、W单质按物质的量之比1:3:1在高温下反应可制得一种无机非金属材料AlW,该反应的化学方程式为
Al2O3+3C+N2=2AlN+3CO
Al2O3+3C+N2=2AlN+3CO
,当0.2mol W单质参加反应,转移电子数目是1.2NA
1.2NA
(5)新型纳米材料ZnFe2Xa可由化合物ZnFe2X4经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
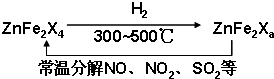
若2mol ZnFe2X a与SO2反应可生成0.75mol S,a=
3.25
3.25
;2molZnFe2Xa可分解物质的量之比为3:2的NO2、NO混合气体(均分解为N2)的体积V=21
21
L(标准状况)(6)在t℃时,将a g NH3完全溶于X的常见氢化物,得到V mL溶液,假如该溶液的密度为d g/cm3,质量分数为w,其中含NH4+的物质的量为b mol.下列叙述正确的是
C
C
A.溶质的质量分数为w=
| a |
| Vd-a |
B.氨水的物质的量浓度为
| 1000a |
| 35V |
C.溶液中c(OH-)=
| 1000b |
| V |
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w.
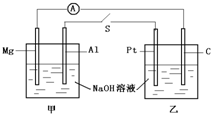 如图所示,将两烧杯用导线如图相连,Pt、Mg、A1、C分别为四个电极,当闭合开关S后,以下表述正确的是( )
如图所示,将两烧杯用导线如图相连,Pt、Mg、A1、C分别为四个电极,当闭合开关S后,以下表述正确的是( )