摘要:3.置换法:如Cl2+2NaBr=2NaCl+Br2 2H2S+O22H2O+2S
网址:http://m.1010jiajiao.com/timu3_id_36711[举报]
海洋约占地球表面积的71%,是一个远未完全开发的巨大化学资源宝库,海水水资源的利用和海水化学资源的利用具有非常广阔的前景.回答下列问题:
(1)海水淡化处理多用蒸馏法.如图是海水蒸馏原理示意图.蒸馏法的特点是设备结构、操作简单,淡水质量好,但也具有明显的缺陷.

1你认为蒸馏法进行海水淡化的主要缺陷是
②我省某沿海地区拟采用蒸馏法兴建一座大型海水淡化工厂,为克服蒸馏法海水淡化的缺陷,请你为该地区提出一条合理化建议
(2)海水淡化后得到的淡水应进行技术处理后才能得到完全满足生产、生活要求的水,使用离子交换树脂与水中的离子进行交换是常用的水处理技术.聚丙烯酸钠是一种离子交换树脂,已知丙烯酸钠的化学式为CH2=CH-COONa试写出生成聚丙烯酸钠的化学方程:
(3)从海水中可以获取食盐、镁、钾、溴及其化工产品.空气吹出法是目前从海水中提取溴的常用方法,具体流程如下:

①实验室中粗盐提纯的步骤是
②反应的离子方程式分别为
③在反应中消耗标况下896m3SO2时,共转移
(4)上述流程中虚线方框内生产流程的作用是
查看习题详情和答案>>
(1)海水淡化处理多用蒸馏法.如图是海水蒸馏原理示意图.蒸馏法的特点是设备结构、操作简单,淡水质量好,但也具有明显的缺陷.

1你认为蒸馏法进行海水淡化的主要缺陷是
消耗大量的能量,成本太高
消耗大量的能量,成本太高
;②我省某沿海地区拟采用蒸馏法兴建一座大型海水淡化工厂,为克服蒸馏法海水淡化的缺陷,请你为该地区提出一条合理化建议
利用风能或太阳能
利用风能或太阳能
;(2)海水淡化后得到的淡水应进行技术处理后才能得到完全满足生产、生活要求的水,使用离子交换树脂与水中的离子进行交换是常用的水处理技术.聚丙烯酸钠是一种离子交换树脂,已知丙烯酸钠的化学式为CH2=CH-COONa试写出生成聚丙烯酸钠的化学方程:
nCH2=CH-COONa

| 催化剂 |

nCH2=CH-COONa

;| 催化剂 |

(3)从海水中可以获取食盐、镁、钾、溴及其化工产品.空气吹出法是目前从海水中提取溴的常用方法,具体流程如下:

①实验室中粗盐提纯的步骤是
溶解,过滤,蒸发结晶
溶解,过滤,蒸发结晶
;在反应②中得到的溶液中通入空气、水蒸汽的作用是吹出溴蒸气
吹出溴蒸气
;②反应的离子方程式分别为
2Cl-+2H2O
2OH-+Cl2↑+H2↑;Cl2+2Br-=Br2+2Cl-;SO2+Br2+2H2O=4H++2Br-+SO42-
| ||
2Cl-+2H2O
2OH-+Cl2↑+H2↑;Cl2+2Br-=Br2+2Cl-;SO2+Br2+2H2O=4H++2Br-+SO42-
;
| ||
③在反应中消耗标况下896m3SO2时,共转移
80000
80000
mol电子;(4)上述流程中虚线方框内生产流程的作用是
富集溴单质
富集溴单质
. 目前世界上比较先进的电解制碱技术是离子交换法,如图为离子交换膜法电解饱和食盐水的原理示意图.
目前世界上比较先进的电解制碱技术是离子交换法,如图为离子交换膜法电解饱和食盐水的原理示意图.(1)下列说法不正确的是
D
D
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4L Cl2,便产生2mol NaOH
D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加 Na2CO3溶液
(2)现有离子交换膜A和B将电解槽分为I、II、III三个区域(下图所示),在这种电解池中电解Na2SO4溶液可制得氢氧化钠、硫酸等物质.A为
阳
阳
离子交换膜、B为阴
阴
离子交换膜(填“阴”或“阳”),电极均为惰性电极.Na2SO4溶液应该在Ⅱ
Ⅱ
区(填“I”、“II”、“III”)加入.通电电解时阴极的电极反应式为2H2O+2e-═H2↑+2OH-
2H2O+2e-═H2↑+2OH-
,在III区得到H2SO4溶液、氧气
H2SO4溶液、氧气
.当外电路总共通过30mol电子时,生成的NaOH 960克,则电解过程中能量的转化率为:80%
80%
.(1)依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图1所示.请回答下列问题:
①电极X上发生的电极反应为
②外电路中的电子是从
③盐桥中盛有饱和KCl的琼脂溶液,放电过程中向CuSO4溶液扩散的是(

(2)①金属腐蚀一般可分为化学腐蚀和.炒过菜的铁锅未及时清洗容易发生电化学腐蚀而生锈.请写出铁锅生锈过程中:
负极的电极反应式:
②据统计,每年由于金属腐蚀造成的钢铁损失约占当年钢产量的10~20%.学校内的自行车防雨棚采用了钢架结构,但使用不久就会生锈.为了使它有比较长的使用寿命,需要采取防锈措施.请同学们提出防止自行车棚的钢架锈蚀的措施:
(3)目前世界上比较先进的电解制碱技术是离子交换膜法,如图2为离子交换膜法电解饱和食盐水的原理示意图.
①写出电解过程中总的化学方程式
②透过交换膜的离子a是
查看习题详情和答案>>
①电极X上发生的电极反应为
Cu=Cu2++2e-
Cu=Cu2++2e-
;②外电路中的电子是从
Cu
Cu
电极流向Ag
Ag
电极(填电极材料名称).③盐桥中盛有饱和KCl的琼脂溶液,放电过程中向CuSO4溶液扩散的是(
Cl-
Cl-
填离子符号)
(2)①金属腐蚀一般可分为化学腐蚀和.炒过菜的铁锅未及时清洗容易发生电化学腐蚀而生锈.请写出铁锅生锈过程中:
负极的电极反应式:
Fe=Fe2+2e-
Fe=Fe2+2e-
,正极的电极反应式:O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.②据统计,每年由于金属腐蚀造成的钢铁损失约占当年钢产量的10~20%.学校内的自行车防雨棚采用了钢架结构,但使用不久就会生锈.为了使它有比较长的使用寿命,需要采取防锈措施.请同学们提出防止自行车棚的钢架锈蚀的措施:
喷漆;焊上一块锌
喷漆;焊上一块锌
(写出2种即可)(3)目前世界上比较先进的电解制碱技术是离子交换膜法,如图2为离子交换膜法电解饱和食盐水的原理示意图.
①写出电解过程中总的化学方程式
2NaCl+2H2O
2NaOH+Cl2↑+H2↑
| ||
2NaCl+2H2O
2NaOH+Cl2↑+H2↑
| ||
②透过交换膜的离子a是
Na+
Na+
.KClO3和KIO3在日常生活、工农业生产和科研方面有着广泛的应用.
(1)实验室可用KClO3分解制取O2,KClO3受热分解的反应分两步进行:①4KClO3(s)=3KClO4(s)+KCl(s);②KClO4(s)=KCl(s)+2O2(g).已知:
K(s)+
Cl2(g)=KCl(s)△H=-437kJ?mol-1
K(s)+
Cl2(g)+
O2(g)=KClO3(s)△H=-398kJ?mol-1
K(s)+
Cl2(g)+2O2(g)=KClO4(s)△H=-433kJ?mol-1
则反应4KClO3(s)=3KClO4(s)+KCl(s)的△H=
(2)Ca(IO3)2是食品及饲料添加剂补充碘源的优良品种.工业上生产Ca(IO3)2的方法通常有两类:
方法一:氧化剂氧化法.如:用KClO3在盐酸存在条件下,将碘单质氧化为HIO3(KClO3被还原为Cl2),然后加Ca(OH)2中和制得Ca(IO3)2.
方法二:电化学氧化法.用适宜浓度的KOH溶液溶解工业精碘作为阳极液(3I2+6KOH=5KI+KIO3+3H2O),用稀KOH溶液为阴极液,电解氧化制 备KIO3,与CaCl2反应得到Ca(IO3)2.
①用KClO3氧化碘单质是一剧烈的放热反应,所以要控制加料速度,与电解氧化法相比缺点主要有
②电化学氧化法电解时的阳极反应式是
③某工厂用电化学氧化法制取Ca(IO3)2,每1kg碘单质理论上可生产纯度为97.8%Ca(IO3)2的质量为
查看习题详情和答案>>
(1)实验室可用KClO3分解制取O2,KClO3受热分解的反应分两步进行:①4KClO3(s)=3KClO4(s)+KCl(s);②KClO4(s)=KCl(s)+2O2(g).已知:
K(s)+
| 1 |
| 2 |
K(s)+
| 1 |
| 2 |
| 3 |
| 2 |
K(s)+
| 1 |
| 2 |
则反应4KClO3(s)=3KClO4(s)+KCl(s)的△H=
-144kJ/mol
-144kJ/mol
kJ/mol.(2)Ca(IO3)2是食品及饲料添加剂补充碘源的优良品种.工业上生产Ca(IO3)2的方法通常有两类:
方法一:氧化剂氧化法.如:用KClO3在盐酸存在条件下,将碘单质氧化为HIO3(KClO3被还原为Cl2),然后加Ca(OH)2中和制得Ca(IO3)2.
方法二:电化学氧化法.用适宜浓度的KOH溶液溶解工业精碘作为阳极液(3I2+6KOH=5KI+KIO3+3H2O),用稀KOH溶液为阴极液,电解氧化制 备KIO3,与CaCl2反应得到Ca(IO3)2.
①用KClO3氧化碘单质是一剧烈的放热反应,所以要控制加料速度,与电解氧化法相比缺点主要有
反应剧烈,需要控制速率;反应过程中产生氯气,对生产操作环境有较大污染
反应剧烈,需要控制速率;反应过程中产生氯气,对生产操作环境有较大污染
.②电化学氧化法电解时的阳极反应式是
I-+6OH--6e-=IO3-+3H2O
I-+6OH--6e-=IO3-+3H2O
.③某工厂用电化学氧化法制取Ca(IO3)2,每1kg碘单质理论上可生产纯度为97.8%Ca(IO3)2的质量为
1.57kg
1.57kg
kg(计算结果保留叁位有效数字).实验室用MnO2和浓盐酸加热制取纯净干燥的氯气,如下图所示。
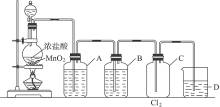
(1)制取Cl2的化学反应方程式______________________。
(2)A瓶中液体是___________,其作用___________,原因___________。B瓶中液体是___________,其作用___________。C瓶采取___________排空气法,是因为Cl2密度___________空气。D烧杯中液体的成分是___________,其作用是___________,发生反应的方程式___________。
(3)使用分液漏斗滴加浓盐酸,是利用分液漏斗有活塞可以___________、___________。如果没有分液漏斗而只有长颈漏斗和小试管,则___________(填“可以”或“不可以”)替?代它。
查看习题详情和答案>>