摘要:2.分解法:如2KClO32KCl+3O2↑ CH4C+2H2 2H2O22H2O+O2↑
网址:http://m.1010jiajiao.com/timu3_id_36710[举报]
我国目前制备多晶硅主要采用三氯氢硅氢还原法、硅烷热解法和四氯化硅氢还原法.由于三氯氢硅还原法具有一定优点,被广泛应用.其简化的工艺流程如图所示:
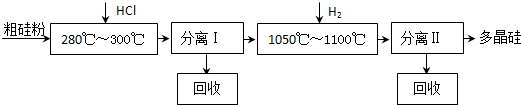
(1)制备三氯氢硅的反应为:Si(s)+3HCl(g)═SiHCl3(g)+H2(g)△H=-210kJ?mol-1.
伴随的副反应有:Si(s)+4HCl(g)═SiCl4(g)+2H2(g)△H=-241kJ?mol-1.
SiCl4在一定条件下与H2反应可转化为SiHCl3,反应的热化学方程式为:
SiCl4(g)+H2(g)═SiHCl3(g)+HCl(g)△H= .
(2)由纯SiHCl3制备高纯硅的化学反应方程式为 .该生产工艺中可以循环使用的物质是 (至少写出两种).
(3)由于SiH4具有易提纯的特点,因此硅烷热分解法是制备高纯硅很有发展潜力的方法.工业上广泛采用的合成硅烷方法是让硅化镁和固体氯化铵在液氨介质中反应得到硅烷,化学方程式是 ;整个制备过程必须严格控制无水,否则反应将不能生成硅烷,而是生成硅酸和氢气等,其化学方程式为 ;整个系统还必须与氧隔绝,其原因是 .
查看习题详情和答案>>

(1)制备三氯氢硅的反应为:Si(s)+3HCl(g)═SiHCl3(g)+H2(g)△H=-210kJ?mol-1.
伴随的副反应有:Si(s)+4HCl(g)═SiCl4(g)+2H2(g)△H=-241kJ?mol-1.
SiCl4在一定条件下与H2反应可转化为SiHCl3,反应的热化学方程式为:
SiCl4(g)+H2(g)═SiHCl3(g)+HCl(g)△H=
(2)由纯SiHCl3制备高纯硅的化学反应方程式为
(3)由于SiH4具有易提纯的特点,因此硅烷热分解法是制备高纯硅很有发展潜力的方法.工业上广泛采用的合成硅烷方法是让硅化镁和固体氯化铵在液氨介质中反应得到硅烷,化学方程式是
常见金属的冶炼方法
(1)热分解法:适用于冶炼金属活动性较差的金属(金属活动顺序表中 及其以后的金属),如:
(2)电解法:适合冶炼活动性很强的金属(一般在金属活动性顺序表中排在 及其以前的金属).如: ;
; ;
(3)热还原法:用还原剂(C、CO、H2、Al等)还原金属氧化物,适用于金属活动性顺序表中的 与 之间的大多数金属的冶炼.如: ; ; ; ; ;
铝热反应实验现象及化学方程式:
实验说明:
a、Al与Fe2O3能发生铝热反应,与其它较不活泼金属氧化物也能发生铝热反应.
b、铝热反应的最大特点是放出大量的热,在生产上利用这一特点,可用于焊接钢轨,冶金工业上也常用这一原理,使铝与金属氧化物反应,冶炼钒、铬、锰等.如:
Al+ MnO2═ .
查看习题详情和答案>>
(1)热分解法:适用于冶炼金属活动性较差的金属(金属活动顺序表中
(2)电解法:适合冶炼活动性很强的金属(一般在金属活动性顺序表中排在
(3)热还原法:用还原剂(C、CO、H2、Al等)还原金属氧化物,适用于金属活动性顺序表中的
铝热反应实验现象及化学方程式:
| 现 象 | |
| 铝与氧化铁反应的化学方程式 |
a、Al与Fe2O3能发生铝热反应,与其它较不活泼金属氧化物也能发生铝热反应.
b、铝热反应的最大特点是放出大量的热,在生产上利用这一特点,可用于焊接钢轨,冶金工业上也常用这一原理,使铝与金属氧化物反应,冶炼钒、铬、锰等.如:
在图1物质转化关系中,反应的条件和部分产物已略去.其中A为常用的溶剂,B为常见的有色气体单质.
回答下列问题:若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应.
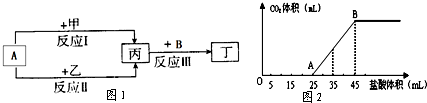
(1)反应I中,甲在通常条件下和A剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是 .
A.热分解法 B.热还原法 C.电解法
(2)反应Ⅱ中,乙与A在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是 .
(3)通过比较反应I、Ⅱ的反应条件,可得出甲的金属性比乙的金属性强弱关系,比较二者金属性强弱的依据还可以是 (写出一种即可).
(4)将3.5g甲的碳酸盐、碳酸氢盐和氢氧化物的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图2所示.
①写出OA段所发生反应的离子方程式 .
②当加入35mL盐酸时,产生CO2的体积为 mL(标准状况).
(5)若甲、乙是化合物,反应Ⅲ是工业制漂白液的反应.其中乙为含有非极性键的离子化合物,若向氯化亚铁溶液中加入固体乙,产生红褐色沉淀,但无气体生成,该反应的离子方程式为 .
查看习题详情和答案>>
回答下列问题:若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应.

(1)反应I中,甲在通常条件下和A剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是
A.热分解法 B.热还原法 C.电解法
(2)反应Ⅱ中,乙与A在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是
(3)通过比较反应I、Ⅱ的反应条件,可得出甲的金属性比乙的金属性强弱关系,比较二者金属性强弱的依据还可以是
(4)将3.5g甲的碳酸盐、碳酸氢盐和氢氧化物的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图2所示.
①写出OA段所发生反应的离子方程式
②当加入35mL盐酸时,产生CO2的体积为
(5)若甲、乙是化合物,反应Ⅲ是工业制漂白液的反应.其中乙为含有非极性键的离子化合物,若向氯化亚铁溶液中加入固体乙,产生红褐色沉淀,但无气体生成,该反应的离子方程式为
利用化石燃料开采、加工过程产生的H2S废气制取氢气,既价廉又环保.

(1)工业上可用组成为K2O?M2O3?2RO2?nH2O的无机材料纯化制取的氢气
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为
②常温下,不能与M单质发生反应的是 (填序号)
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气来的方法有多种
①高温热分解法
已知:H2S(g)?H2(g)+1/2S2(g)
在恒温密闭容器中,控制不同温度进行H2S分解实验.以H2S起始浓度均为cmol?L-1测定H2S的转化率,结果见右图.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.据图计算985℃时H2S按上述反应分解的平衡常数K= ;说明随温度的升高,曲线b向曲线a逼近的原因:
②电化学法
该法制氢过程的示意图如右.反应池中反应物的流向采用气、液逆流方式,其目的是 ;反应池中发生反应的化学方程式为 .反应后的溶液进入电解池,电解总反应的离子方程式为 .
查看习题详情和答案>>

(1)工业上可用组成为K2O?M2O3?2RO2?nH2O的无机材料纯化制取的氢气
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为
②常温下,不能与M单质发生反应的是
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气来的方法有多种
①高温热分解法
已知:H2S(g)?H2(g)+1/2S2(g)
在恒温密闭容器中,控制不同温度进行H2S分解实验.以H2S起始浓度均为cmol?L-1测定H2S的转化率,结果见右图.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.据图计算985℃时H2S按上述反应分解的平衡常数K=
②电化学法
该法制氢过程的示意图如右.反应池中反应物的流向采用气、液逆流方式,其目的是