题目内容
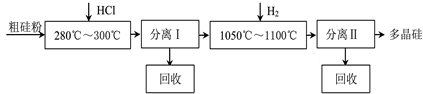
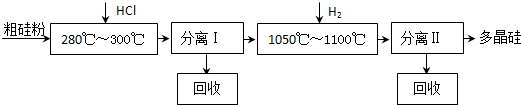
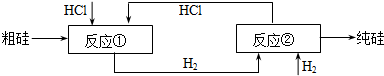
我国目前制备多晶硅主要采用三氯氢硅氢还原法、硅烷热解法和四氯化硅氢还原法.由于三氯氢硅还原法具有一定优点,被广泛应用.其简化的工艺流程如图所示:
(1)制备三氯氢硅的反应为:Si(s)+3HCl(g)═SiHCl3(g)+H2(g)△H=-210kJ?mol-1.
伴随的副反应有:Si(s)+4HCl(g)═SiCl4(g)+2H2(g)△H=-241kJ?mol-1.
SiCl4在一定条件下与H2反应可转化为SiHCl3,反应的热化学方程式为:
SiCl4(g)+H2(g)═SiHCl3(g)+HCl(g)△H= .
(2)由纯SiHCl3制备高纯硅的化学反应方程式为 .该生产工艺中可以循环使用的物质是 (至少写出两种).
(3)由于SiH4具有易提纯的特点,因此硅烷热分解法是制备高纯硅很有发展潜力的方法.工业上广泛采用的合成硅烷方法是让硅化镁和固体氯化铵在液氨介质中反应得到硅烷,化学方程式是 ;整个制备过程必须严格控制无水,否则反应将不能生成硅烷,而是生成硅酸和氢气等,其化学方程式为 ;整个系统还必须与氧隔绝,其原因是 .

(1)制备三氯氢硅的反应为:Si(s)+3HCl(g)═SiHCl3(g)+H2(g)△H=-210kJ?mol-1.
伴随的副反应有:Si(s)+4HCl(g)═SiCl4(g)+2H2(g)△H=-241kJ?mol-1.
SiCl4在一定条件下与H2反应可转化为SiHCl3,反应的热化学方程式为:
SiCl4(g)+H2(g)═SiHCl3(g)+HCl(g)△H=
(2)由纯SiHCl3制备高纯硅的化学反应方程式为
(3)由于SiH4具有易提纯的特点,因此硅烷热分解法是制备高纯硅很有发展潜力的方法.工业上广泛采用的合成硅烷方法是让硅化镁和固体氯化铵在液氨介质中反应得到硅烷,化学方程式是
分析:(1)根据盖斯定律可以计算化学反应的焓变;
(2)利用氢气和纯SiHCl3反应制备高纯硅,过程中反应后最后又生成的物质可以循环使用;
(3)根据题目信息和已知条件来书写方程式;
(2)利用氢气和纯SiHCl3反应制备高纯硅,过程中反应后最后又生成的物质可以循环使用;
(3)根据题目信息和已知条件来书写方程式;
解答:解:(1)根据盖斯定律,反应SiCl4(g)+H2(g)═SiHCl3(g)+HCl(g)可以看成是Si(s)+3HCl(g)═SiHCl3(g)+H2(g)和反应Si(s)+4HCl(g)═SiCl4(g)+2H2(g)的差,所以△H═-210kJ?mol-1-(-241kJ?mol-1)=+31 kJ?mol-1,故答案为:+31 kJ?mol-1;
(2)利用氢气和纯SiHCl3反应制备高纯硅,反应的化学方程式为:SiHCl3+H2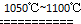 Si+3HCl;依据流程关系和反应产物分析,该生产工艺中可以循环使用的物质是 HCl、H2、SiHCl3等;
Si+3HCl;依据流程关系和反应产物分析,该生产工艺中可以循环使用的物质是 HCl、H2、SiHCl3等;
故答案为:SiHCl3+H2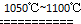 Si+3HCl; HCl、H2、SiHCl3等;
Si+3HCl; HCl、H2、SiHCl3等;
(3)硅化镁和固体氯化铵在液氨介质中反应得到硅烷,根据原子守恒,则Mg2Si+4NH4Cl═SiH4↑+2MgCl2+4NH3↑,整个系统还必须与氧隔绝,否则容易发生爆炸,硅化镁和固体氯化铵在水中反应得到硅酸和氢气等,根据原子守恒,则Mg2Si+4NH4Cl+3H2O═2MgCl2+H2SiO3+4NH3↑+4H2↑,
故答案为:Mg2Si+4NH4Cl═SiH4↑+2MgCl2+4NH3↑;Mg2Si+4NH4Cl+3H2O═2MgCl2+H2SiO3+4NH3↑+4H2↑;由于硅烷在空气中易燃,浓度高时容易发生爆炸;
(2)利用氢气和纯SiHCl3反应制备高纯硅,反应的化学方程式为:SiHCl3+H2
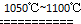 Si+3HCl;依据流程关系和反应产物分析,该生产工艺中可以循环使用的物质是 HCl、H2、SiHCl3等;
Si+3HCl;依据流程关系和反应产物分析,该生产工艺中可以循环使用的物质是 HCl、H2、SiHCl3等;故答案为:SiHCl3+H2
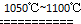 Si+3HCl; HCl、H2、SiHCl3等;
Si+3HCl; HCl、H2、SiHCl3等;(3)硅化镁和固体氯化铵在液氨介质中反应得到硅烷,根据原子守恒,则Mg2Si+4NH4Cl═SiH4↑+2MgCl2+4NH3↑,整个系统还必须与氧隔绝,否则容易发生爆炸,硅化镁和固体氯化铵在水中反应得到硅酸和氢气等,根据原子守恒,则Mg2Si+4NH4Cl+3H2O═2MgCl2+H2SiO3+4NH3↑+4H2↑,
故答案为:Mg2Si+4NH4Cl═SiH4↑+2MgCl2+4NH3↑;Mg2Si+4NH4Cl+3H2O═2MgCl2+H2SiO3+4NH3↑+4H2↑;由于硅烷在空气中易燃,浓度高时容易发生爆炸;
点评:本题是一道有关硅和二氧化硅性质的综合题,难度较大,考查学生分析和解决问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
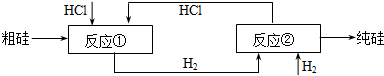
(10分)我国目前制备多晶硅主要采用三氯氢硅氢还原法、硅烷热解法和四氯化硅氢还
原法。由于三氯氢硅还原法具有一定优点,被广泛应用。其简化的工艺流程如图所示:
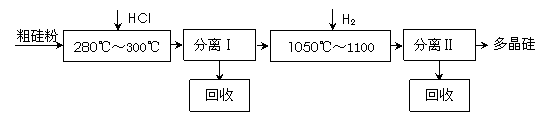 |
(1)制备三氯氢硅的反应为:Si(s)+3HCl(g) == SiHCl3(g)+H2(g) ΔH=-210 kJ•mol-1。
伴随的副反应有:Si(s)+4HCl(g) == SiCl4(g)+2H2(g) ΔH=-241 kJ•mol-1。
SiCl4在一定条件下与H2反应可转化为SiHCl3,反应的热化学方程式为:
![]() SiCl4(g)+H2(g) == SiHCl3(g)+HCl(g) ΔH= 。
SiCl4(g)+H2(g) == SiHCl3(g)+HCl(g) ΔH= 。
(2)由纯SiHCl3制备高纯硅的化学反应方程式为 。该生产工艺中可以循环使用的物质是 (至少写出两种)。
(3)由于SiH4具有易提纯的特点,因此硅烷热分解法是制备高纯硅很有发展潜力的方法。工业上广泛采用的合成硅烷方法是让硅化镁和固体氯化铵在液氨介质中反应得到硅烷,化学方程式是 ;整个制备过程必须严格控制无水,否则反应将不能生成硅烷,而是生成硅酸和氢气等,其化学方程式为 ;整个系统还必须与氧隔绝,其原因是 。
 SiHCl3(l)+H2(g)
SiHCl3(l)+H2(g)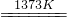 Si(纯)+3HCl
Si(纯)+3HCl