题目内容
在图1物质转化关系中,反应的条件和部分产物已略去.其中A为常用的溶剂,B为常见的有色气体单质.
回答下列问题:若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应.
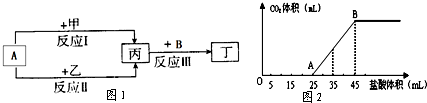
(1)反应I中,甲在通常条件下和A剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是 .
A.热分解法 B.热还原法 C.电解法
(2)反应Ⅱ中,乙与A在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是 .
(3)通过比较反应I、Ⅱ的反应条件,可得出甲的金属性比乙的金属性强弱关系,比较二者金属性强弱的依据还可以是 (写出一种即可).
(4)将3.5g甲的碳酸盐、碳酸氢盐和氢氧化物的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图2所示.
①写出OA段所发生反应的离子方程式 .
②当加入35mL盐酸时,产生CO2的体积为 mL(标准状况).
(5)若甲、乙是化合物,反应Ⅲ是工业制漂白液的反应.其中乙为含有非极性键的离子化合物,若向氯化亚铁溶液中加入固体乙,产生红褐色沉淀,但无气体生成,该反应的离子方程式为 .
回答下列问题:若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应.

(1)反应I中,甲在通常条件下和A剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是
A.热分解法 B.热还原法 C.电解法
(2)反应Ⅱ中,乙与A在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是
(3)通过比较反应I、Ⅱ的反应条件,可得出甲的金属性比乙的金属性强弱关系,比较二者金属性强弱的依据还可以是
(4)将3.5g甲的碳酸盐、碳酸氢盐和氢氧化物的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图2所示.
①写出OA段所发生反应的离子方程式
②当加入35mL盐酸时,产生CO2的体积为
(5)若甲、乙是化合物,反应Ⅲ是工业制漂白液的反应.其中乙为含有非极性键的离子化合物,若向氯化亚铁溶液中加入固体乙,产生红褐色沉淀,但无气体生成,该反应的离子方程式为
分析:B为常见的有色气体单质,反应Ⅲ是工业制盐酸的反应,可知B为Cl2,丙为H2,A为常用的溶剂,应为H2O,
(1)反应I中,甲在通常条件下和A剧烈反应,应为钠和水的反应,生成氢氧化钠和氢气;
(2)反应Ⅱ中,乙与A在高温下反应,除丙外,还生成一种有磁性的物质,应为铁和水蒸气的反应;
(3)比较金属性强弱,可根据与水反应的剧烈程度或者最高价氧化物对应水化物的碱性强弱判断;
(4)加入盐酸到25mL时生成气体,则OA段首先和OH-反应生成水,然后和CO32-反应生成HCO3-;当加入35mL盐酸时,根据横坐标以及反应HCO3-+H+=CO2↑+H2O计算;
(5)乙为含有非极性键的离子化合物,应为Na2O2,若向氯化亚铁溶液中加入固体Na2O2,产生红褐色沉淀,但无气体生成,可生成Fe(OH)3.
(1)反应I中,甲在通常条件下和A剧烈反应,应为钠和水的反应,生成氢氧化钠和氢气;
(2)反应Ⅱ中,乙与A在高温下反应,除丙外,还生成一种有磁性的物质,应为铁和水蒸气的反应;
(3)比较金属性强弱,可根据与水反应的剧烈程度或者最高价氧化物对应水化物的碱性强弱判断;
(4)加入盐酸到25mL时生成气体,则OA段首先和OH-反应生成水,然后和CO32-反应生成HCO3-;当加入35mL盐酸时,根据横坐标以及反应HCO3-+H+=CO2↑+H2O计算;
(5)乙为含有非极性键的离子化合物,应为Na2O2,若向氯化亚铁溶液中加入固体Na2O2,产生红褐色沉淀,但无气体生成,可生成Fe(OH)3.
解答:解:B为常见的有色气体单质,反应Ⅲ是工业制盐酸的反应,可知B为Cl2,丙为H2,A为常用的溶剂,应为H2O,
(1)反应I中,甲在通常条件下和A剧烈反应,应为钠和水的反应,生成氢氧化钠和氢气,工业冶炼金属钠,应用电解法冶炼,故答案为:C;
(2)反应Ⅱ中,乙与A在高温下反应,除丙外,还生成一种有磁性的物质,应为铁和水蒸气的反应,反应的方程式为3Fe+4H2O(g)
Fe3O4+4H2,
故答案为:3Fe+4H2O(g)
Fe3O4+4H2;
(3)比较金属性强弱,可根据与水反应的剧烈程度或者最高价氧化物对应水化物的碱性强弱判断,NaOH是强碱,Fe(OH)3是弱碱,可说明Na比Fe的金属性强,
故答案为:NaOH是强碱,Fe(OH)3是弱碱;
(4)①加入盐酸到25mL时生成气体,则OA段首先和OH-反应生成水,然后和CO32-反应生成HCO3-,反应的方程式为H++OH-=H2O、CO32-+H+=HCO3-,
故答案为:H++OH-=H2O、CO32-+H+=HCO3-;
②当加入35mL盐酸时,发生HCO3-+H+=CO2↑+H2O,此时消耗盐酸为10mL,物质的量为0.01L×1mol?L-1=0.01mol,
体积为0.01mol×22.4L/mol=0.224L=224mL,
故答案为:224;
(5)乙为含有非极性键的离子化合物,应为Na2O2,若向氯化亚铁溶液中加入固体Na2O2,产生红褐色沉淀,但无气体生成,可生成Fe(OH)3,反应的化学方程式为3Fe2++6Na2O2+6H2O=4Fe(OH)3↓+2Fe3++6Na+,
故答案为:3Fe2++6Na2O2+6H2O=4Fe(OH)3↓+2Fe3++6Na+.
(1)反应I中,甲在通常条件下和A剧烈反应,应为钠和水的反应,生成氢氧化钠和氢气,工业冶炼金属钠,应用电解法冶炼,故答案为:C;
(2)反应Ⅱ中,乙与A在高温下反应,除丙外,还生成一种有磁性的物质,应为铁和水蒸气的反应,反应的方程式为3Fe+4H2O(g)
| ||
故答案为:3Fe+4H2O(g)
| ||
(3)比较金属性强弱,可根据与水反应的剧烈程度或者最高价氧化物对应水化物的碱性强弱判断,NaOH是强碱,Fe(OH)3是弱碱,可说明Na比Fe的金属性强,
故答案为:NaOH是强碱,Fe(OH)3是弱碱;
(4)①加入盐酸到25mL时生成气体,则OA段首先和OH-反应生成水,然后和CO32-反应生成HCO3-,反应的方程式为H++OH-=H2O、CO32-+H+=HCO3-,
故答案为:H++OH-=H2O、CO32-+H+=HCO3-;
②当加入35mL盐酸时,发生HCO3-+H+=CO2↑+H2O,此时消耗盐酸为10mL,物质的量为0.01L×1mol?L-1=0.01mol,
体积为0.01mol×22.4L/mol=0.224L=224mL,
故答案为:224;
(5)乙为含有非极性键的离子化合物,应为Na2O2,若向氯化亚铁溶液中加入固体Na2O2,产生红褐色沉淀,但无气体生成,可生成Fe(OH)3,反应的化学方程式为3Fe2++6Na2O2+6H2O=4Fe(OH)3↓+2Fe3++6Na+,
故答案为:3Fe2++6Na2O2+6H2O=4Fe(OH)3↓+2Fe3++6Na+.
点评:本题考查较为综合,涉及无机物的推断以及离子方程式的计算,侧重于学生的分析能力和计算能力的考查,注意把握物质的性质,把握推断的突破口,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


 甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.
甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系. (2010?西城区一模)甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.甲+乙→丙+丁
(2010?西城区一模)甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.甲+乙→丙+丁
 请按要求回答下列问题:
请按要求回答下列问题: