网址:http://m.1010jiajiao.com/timu3_id_366282[举报]
某小组同学欲制备SO2并探究其性质:
(一)实验室中需要SO2气体22.4 L(标准状况)。依据化学方程式Zn + 2 H2SO4(浓)![]() ZnSO4 + SO2↑ + 2 H2O计算后,取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g/mL)110 mL充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有杂质。
ZnSO4 + SO2↑ + 2 H2O计算后,取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g/mL)110 mL充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有杂质。
(1)所制得的气体中混有的杂质气体可能是 (填分子式)。产生这种杂质的主要原因是 (用化学方程式表达)。
(2)为证实相关分析,组装了如下装置,对所制取的气体进行探究。
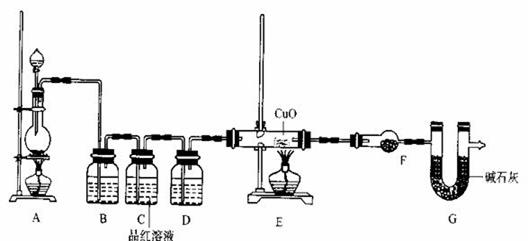
①装置B中加入的试剂是 ,作用是 。
②装置D中加入的试剂是 ,装置F中加入的试剂 是 。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有该杂质气体的实验现象是 。
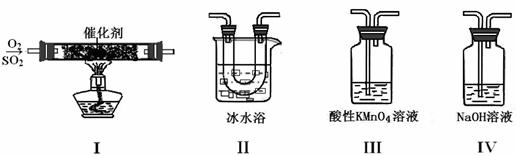
(二)利用下图所示的装置探究S![]() O2的性质:
O2的性质:
已知:熔点![]() :SO2 - 76.1℃,SO3 16.8℃;沸点:SO2 - 10℃,SO3 45℃
:SO2 - 76.1℃,SO3 16.8℃;沸点:SO2 - 10℃,SO3 45℃
| |
|
|
(1)装置I模拟工业生产SO3的反应,其化学方程式是 。
(2)甲同学按I、II、III、IV的顺序连接装置,装置II的作用是
;装置III中溶液![]() 逐渐褪色,有Mn2+生成,同时溶液酸性
逐渐褪色,有Mn2+生成,同时溶液酸性![]() 增强,则该反应的离子方程式是 。
增强,则该反应的离子方程式是 。
(3)乙同学按I、II、IV的顺序连接装置,若装置IV中有40 mL 2.5 mol??L-1 NaOH溶液,反应后溶液增重 4.8 g,则反应后溶液中含有的溶质有
(填化学式),对应溶质物质的量之比为 。
查看习题详情和答案>>
(1)Ⅰ中b瓶内加入的液体最好是
图示的Ⅱ或Ⅲ能代替Ⅰ的是
(2)G装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为二氧化碳和氯化氢,实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让氯气充满整个装置,再点燃G处酒精灯,回答下列问题:
①B装置中的现象是
②怎样证明氯气已充满了整个装置?
③G中反应的化学方程式:
| ||
| ||
(3)某同学利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理.吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO
2- |
①提出合理假设
假设1:只存在SO
2- 3 |
假设2:既不存在SO
2- 3 |
假设3:
②设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3mol/L H2SO4、1mol/L NaOH、0.01mol/L KMnO4、淀粉KI溶液、紫色石蕊试液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 | ----- |
| 步骤2: | |
| 步骤3: |
 化学是一门以实验为基础的自然科学.
化学是一门以实验为基础的自然科学.(1)下列说法中,符合实验安全规范要求的是
①闻气体的气味时,应用手在瓶口轻轻煽动,使少量的气体飘进鼻孔
②在实验室做铜和浓硝酸反应制备二氧化氮的实验时,应该在通风橱中进行
③做H2还原CuO实验时,先加热CuO至高温,然后立即通入H2使反应发生
④实验中当有少量的过氧化钠剩余时,用纸包裹好后将其放入垃圾桶中
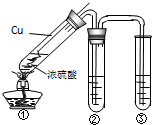
(2)某学习小组用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应及部分产物的性质(装置中的铜丝可适当上下抽动).
①当反应进行一段时间后,欲使反应迅速停止,可采取的措施为
②若装置②用来检验生成的气体产物的性质,在装置②的试管中加入的试剂为品红试液,通入气体后,现象为
③装置③中盛有某单质的水溶液,用来检验气体产物的还原性,则该单质的水溶液为
④实验最后,要将图①大试管中的液体与水混合,以观察颜色检验存在的离子,从安全角度考虑,混合的方法应该是
⑤实验中,在所用仪器及仪器间连接都完好的情况下,同学们仍闻到了较强的刺激性气味,说明此实验的整套装置设计有缺陷,会造成空气污染.改进此实验装置的方法是
某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如下图所示的实验装置。
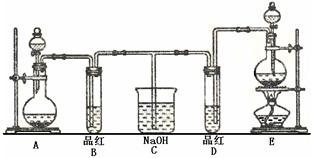
(1)实验室常选用制CO2的发生装置制SO2;实验室在用MnO2跟浓盐酸反应制备Cl2时,应选用上图A、E两发生装置中 ▲ 装置(填装置序号)制Cl2。在制Cl2的反应中浓盐酸所表现出的性质是 ▲ 。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个
试管加热,两个试管中的现象分别为B: ▲ ,D: ▲ 。
(3)装置C的作用是 ▲ 。
(4)甲乙两名同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性。试分析:
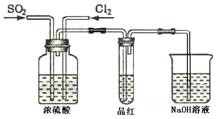
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是: ▲ 。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是: ▲ ,并写出其相应的离子方程式: ▲ 。
③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅,其原因是: ▲ 。
查看习题详情和答案>>(14分)某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如下图所示的实验装置。
(1)实验室常选用制CO2的发生装置制SO2;实验室在用MnO2跟浓盐酸反应制备Cl2时,应选用上图A、E两发生装置中 ▲ 装置(填装置序号)制Cl2。在制Cl2的反应中浓盐酸所表现出的性质是 ▲ 。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个
试管加热,两个试管中的现象分别为B: ▲ ,D: ▲ 。
(3)装置C的作用是 ▲ 。
(4)甲乙两名同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性。试分析:
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是: ▲ 。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是: ▲ ,并写出其相应的离子方程式: ▲ 。
③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅,其原因是: ▲ 。
查看习题详情和答案>>