摘要:(二).钠的化学性质: 1.与非金属单质的反应: (1)与氧的反应:钠很容易被氧化.切开钠会看到 现象.这是因为生成了 . 钠在空气中长久放置最终生成 . 产生反应物相同而产物不同情况的原因包括①反应条件不同.如 ② 不同,如 ③ 不同,如 ④ 不同,如 (2)与其它非金属的反应: 2.与化合物的反应: (1) 钠与水的反应: 离子方程式: 现象 结论 ① ② ③ ④ (2)与盐溶液的反应: (3)与某些有机物的反应: 钠还可以与其它某些含有 官能团的物质发生反应生成氢气.如: 钠与氢气的对应关系为 .钠与此官能团的对应关系为 .
网址:http://m.1010jiajiao.com/timu3_id_365964[举报]
(2011?上海)工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+3CO2↑+9H2O
根据题意完成下列填空:
(1)在上述反应的反应物和生成物中,属于非极性分子的电子式
 ,属于弱酸的电离方程式
,属于弱酸的电离方程式
(2)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是
a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢
(3)反应物中某些元素处于同一周期.它们最高价氧化物对应的水化物之间发生反应的离子方程式为
(4)Na2CO3俗称纯碱,属于
查看习题详情和答案>>
根据题意完成下列填空:
(1)在上述反应的反应物和生成物中,属于非极性分子的电子式


HF?H++F-
HF?H++F-
.(2)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是
ac
ac
(选填编号).a.气态氢化物的稳定性 b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易 d.单质与同浓度酸发生反应的快慢
(3)反应物中某些元素处于同一周期.它们最高价氧化物对应的水化物之间发生反应的离子方程式为
Al(OH)3+OH-═AlO2-+H2O
Al(OH)3+OH-═AlO2-+H2O
.(4)Na2CO3俗称纯碱,属于
离子
离子
晶体.工业上制取纯碱的原料是氯化钠、二氧化碳、氨气
氯化钠、二氧化碳、氨气
.(2011?新疆二模)A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质.B、E均为组成空气的成分.F的焰色反应呈黄色.在G中,非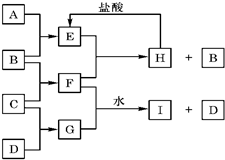 金属元素与金属元素的原子个数比为1:2.在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出):请填写下列空白:
金属元素与金属元素的原子个数比为1:2.在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出):请填写下列空白:
(1)A是
(2)H与盐酸反应生成E的离子方程式是
(3)E与F反应的化学方程式是
(4)F与G(物质的量之比为1:1)的水溶液反应生成I和D的离子方程式是:
查看习题详情和答案>>
 金属元素与金属元素的原子个数比为1:2.在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出):请填写下列空白:
金属元素与金属元素的原子个数比为1:2.在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出):请填写下列空白:(1)A是
碳
碳
;C是钠
钠
;(填写化学式)F中含有的化学键类型有离子键和(非极性)共价键
离子键和(非极性)共价键
(2)H与盐酸反应生成E的离子方程式是
CO32-+2H+═CO2↑+H2O
CO32-+2H+═CO2↑+H2O
;(3)E与F反应的化学方程式是
2CO2+2Na2O2═2Na2CO3+O2
2CO2+2Na2O2═2Na2CO3+O2
;(4)F与G(物质的量之比为1:1)的水溶液反应生成I和D的离子方程式是:
Na2O2+S2-+2H2O═4OH-+S↓+2Na+
Na2O2+S2-+2H2O═4OH-+S↓+2Na+
.(2012?信阳二模)据元素周期表及周期律的知识回答下列问题:
(1)金属钠在一定条件下可与氢气反应生成氢化钠(2Na+H2
2NaH).生成物氢化钠的电子式为
 ,含有的化学键类型为
,含有的化学键类型为
(2)元素周期表中元素的性质存在递变规律,下列比较正确的是
a.离子半径:Na+>Mg2+>S2->Cl-b.酸性:H4SiO4>H3PO4>H2SO4>HClO4
c.氢化物稳定性:PH3<H2S<HCl d.与NaOH溶液反应的剧烈程度:Na>Mg>Al
(3)共价键的极性随共用电子对偏移程度的增大而增强,SiH4、PH3、H2S、HCl共价键的极性由强到弱的顺序是
(4)元素Cl与S元素相比,非金属性较强的是
a.常温下S比Cl2单质的熔点高 b.Cl2与S的氢化物发生反应,产生S单质
c.S与Cl2形成的化合物中S元素呈正价态 d.比较两元素的单质与H2化合时得电子的数目
(5)HF比HCl沸点高,原因是
(6)下表为部分非金属元素与氢形成共价键的键长与键能数据:根据表中数据,归纳共价键键能与键长的关系
查看习题详情和答案>>
(1)金属钠在一定条件下可与氢气反应生成氢化钠(2Na+H2
| 一定条件 |


离子键
离子键
键(填“离子”、“共价”或“金属”).(2)元素周期表中元素的性质存在递变规律,下列比较正确的是
c
c
.a.离子半径:Na+>Mg2+>S2->Cl-b.酸性:H4SiO4>H3PO4>H2SO4>HClO4
c.氢化物稳定性:PH3<H2S<HCl d.与NaOH溶液反应的剧烈程度:Na>Mg>Al
(3)共价键的极性随共用电子对偏移程度的增大而增强,SiH4、PH3、H2S、HCl共价键的极性由强到弱的顺序是
HCl>H2S>PH3>SiH4
HCl>H2S>PH3>SiH4
.(4)元素Cl与S元素相比,非金属性较强的是
Cl
Cl
(用元素符号表示),下列表述中能证明这一事实的是bc
bc
.a.常温下S比Cl2单质的熔点高 b.Cl2与S的氢化物发生反应,产生S单质
c.S与Cl2形成的化合物中S元素呈正价态 d.比较两元素的单质与H2化合时得电子的数目
(5)HF比HCl沸点高,原因是
HF分子之间存在氢键
HF分子之间存在氢键
.(6)下表为部分非金属元素与氢形成共价键的键长与键能数据:根据表中数据,归纳共价键键能与键长的关系
同主族元素原子与相同其他原子形成的共价键,键长越小,键能越大
同主族元素原子与相同其他原子形成的共价键,键长越小,键能越大
| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 341 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
(2010?厦门二模)甲、乙、丙三种物质都含有A元素,只有甲是单质,其转化关系如下:
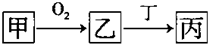
(1)若乙是目前世界倡导需减少排放的温室气体,丁也含有A元素.则含有7个中子的核素A可用符号表示为
(2)若A是非金属元素,其次外层电子是最外层电子数的2倍,则乙在现代通讯中可用于制造
(3)若甲是生活中最常用的过渡金属单质,其在点燃条件下与氧气反应生成乙.若丁是稀硝酸,则乙一丙的化学方程式为
(4)若A元素是第三周期元素,其最高正化合价与负价的绝对值差为4,则乙的化学式为
查看习题详情和答案>>
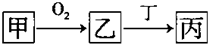
(1)若乙是目前世界倡导需减少排放的温室气体,丁也含有A元素.则含有7个中子的核素A可用符号表示为
613C
613C
,丙溶液呈碱性的原因用离子方程式表示为HCO-3+H2O?H2CO3+OH-
HCO-3+H2O?H2CO3+OH-
;(2)若A是非金属元素,其次外层电子是最外层电子数的2倍,则乙在现代通讯中可用于制造
光导纤维
光导纤维
写出一个有丙参加的、能证明碳的非金属性强于A的化学方程式Na2SiO3+H2O+CO2═H2SiO3↓+Na2CO3
Na2SiO3+H2O+CO2═H2SiO3↓+Na2CO3
;(3)若甲是生活中最常用的过渡金属单质,其在点燃条件下与氧气反应生成乙.若丁是稀硝酸,则乙一丙的化学方程式为
3Fe3O4+28HNO3═9Fe(NO3)3+NO↑+14H2O
3Fe3O4+28HNO3═9Fe(NO3)3+NO↑+14H2O
;(4)若A元素是第三周期元素,其最高正化合价与负价的绝对值差为4,则乙的化学式为
SO2
SO2
,当丁是Ca(OH)2时,往丙中加入碳酸钠溶液,当碳酸钠溶液浓度大于10-5
10-5
mol?L1时,丙可转化为碳酸钙.(已知此温度下,丙物质Ksp=1×10-6,CaCO3的Ksp=1×10-8)短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱.E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成.E被足量氢氧化钠溶液吸收得到无色溶液F.溶液F在空气中长期放置发生反应,生成物之一为H.H与过氧化钠的结构和化学性质相似,其溶液显黄色.请回答下列问题:
(1)组成单质A的元素位于周期表中第________周期,第________族.
(2)B与氢氧化钠溶液反应的化学方程式为:_____________________________________.
(3)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯.该反应的氧化产物为__________,当生成2 mol二氧化氯时,转移电子________mol.
(4)溶液F在空气中长期放置生成H的化学反应方程式为:________________________.
(5)H的溶液与稀硫酸反应产生的现象为_______________________________.
查看习题详情和答案>>
(1)组成单质A的元素位于周期表中第________周期,第________族.
(2)B与氢氧化钠溶液反应的化学方程式为:_____________________________________.
(3)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯.该反应的氧化产物为__________,当生成2 mol二氧化氯时,转移电子________mol.
(4)溶液F在空气中长期放置生成H的化学反应方程式为:________________________.
(5)H的溶液与稀硫酸反应产生的现象为_______________________________.