摘要:.A.B.C.D是短周期元素,A元素的最高价氧化物的水化物与它的气态氢化物反应得到离子化合物,1摩该化合物含有42摩电子,B原子的最外层电子数为次外层的3倍.C.D两原子的最外层电子数分别是内层电子数的一半.C元素是植物生长的营养元素之一. 试写出: (1)A.B元素形成的酸酐的化学式 ; (2)D元素的单质与水反应的化学方程式 ; (3)A.C元素气态氢化物的稳定性大小 < .
网址:http://m.1010jiajiao.com/timu3_id_365924[举报]
(2012?上海模拟)某反应池中,发生“生物硝化过程”,利用O2将NH4+氧化成NO3-,如果不考虑过程中硝化细菌的增殖,其净反应如下式所示:
完成上述反应的离子方程式并配平,将系数填入方框中,并标出电子的转移方向和数目.
(1)反应中,还原剂是
(2)将铵态氮中的lmg氮转化成硝酸根中的氮,需氧气
(3)取100mL完全反应以后的溶液,加入19.2g铜粉及一定量的稀硫酸,恰好完全反应(假设还原产物全部是NO气体),则原溶液中NH4+的浓度为
查看习题详情和答案>>
NH4+
NH4+
+2O2
2O2
| 硝化细菌 |
NO3-
NO3-
+2H+
2H+
+H2O
H2O
完成上述反应的离子方程式并配平,将系数填入方框中,并标出电子的转移方向和数目.
(1)反应中,还原剂是
NH4+
NH4+
,被还原的元素是O2中的O
O2中的O
.(2)将铵态氮中的lmg氮转化成硝酸根中的氮,需氧气
4.57
4.57
mg.(精确到0.01)(3)取100mL完全反应以后的溶液,加入19.2g铜粉及一定量的稀硫酸,恰好完全反应(假设还原产物全部是NO气体),则原溶液中NH4+的浓度为
2
2
mol/L.(假设反应前后溶液的体积不变)(2011?上海模拟)烯烃通过臭氧氧化并经锌和水处理得到醛或酮,例如:
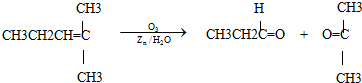
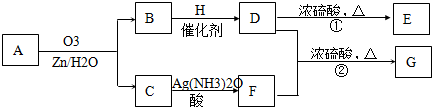
一种链状单烯烃A通过臭氧氧化并经锌和水处理得到B和C.化合物B含碳69.8%,含氢11.6%,B无银镜反应.D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E.G的分子式为C7H14O2C7H14O2.有关转化关系如下;
(1)B的相对分子质量是
(2)写出结构简式:A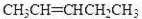
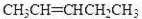 .
.
(3)写出反应①、②的反应类型:①
(4)写出反应②的化学方程式: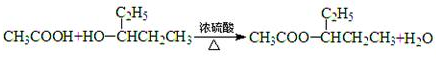
 .
.
(5)F的一种同分异构体能发生酯化反应和银镜反应,其结构简式为
查看习题详情和答案>>
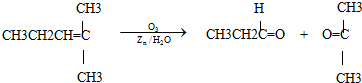
一种链状单烯烃A通过臭氧氧化并经锌和水处理得到B和C.化合物B含碳69.8%,含氢11.6%,B无银镜反应.D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E.G的分子式为C7H14O2C7H14O2.有关转化关系如下;

(1)B的相对分子质量是
86
86
.(2)写出结构简式:A
(CH3CH2)2C=CHCH2CH3
(CH3CH2)2C=CHCH2CH3
、E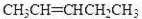
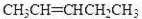
(3)写出反应①、②的反应类型:①
消去反应
消去反应
、②酯化反应
酯化反应
.(4)写出反应②的化学方程式:


(5)F的一种同分异构体能发生酯化反应和银镜反应,其结构简式为
HOCH2CHO
HOCH2CHO
.(2012?上海模拟)X、Y、Z、W是短周期的四种元素,有关它们的信息如下表所示.
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
(1)X单质分子的结构式是
 ,Z元素原子最外层共有
,Z元素原子最外层共有
(2)X、Y、Z三元素的最高价氧化物的水化物酸性由强到弱的顺序是
(3)常温时,W的硫酸盐溶液的pH
(4)25℃、101kPa时,32g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6kJ的热量,写出该反应的热化学方程式
查看习题详情和答案>>
| 元素 | 部分结构知识 | 部分性质 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
(1)X单质分子的结构式是


17
17
种不同运动状态的电子.(2)X、Y、Z三元素的最高价氧化物的水化物酸性由强到弱的顺序是
HClO4>HNO3>H2CO3
HClO4>HNO3>H2CO3
.(3)常温时,W的硫酸盐溶液的pH
<
<
7(填“=”、“>”或“<”),理由是:Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
(用离子方程式表示).(4)25℃、101kPa时,32g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6kJ的热量,写出该反应的热化学方程式
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol
.