网址:http://m.1010jiajiao.com/timu3_id_365837[举报]
| 元素 | A | B | C | D | E | F | G |
| 性 质 结 构 信 息 |
制成的高压灯,发出的黄光透雾能力强、射程远. | 工业上通过分离液态空气获得其单质.原子的最外层未达稳定结构. | 常温常压下是气体,元素的常见化合价为-1及多种正价. | +2价阳离子核外电子数与氖原子相同. | E和F是同主族元素,都有同素异形体.E的一种分子与F原子电子数目相同. | 常温下,其单质能与烧碱溶液反应放出气体,其氧化物能与强酸或强碱溶液反应. | |
(2)写出D离子的结构示意图


(3)写出C单质与水反应的化学方程式
(4)写出G与烧碱溶液反应的离子方程式
(5)写出F元素常见的两种同素异形体的名称
(6)对元素B的单质或化合物描述正确的是(填序号)
①B元素的最高正价为+6 ②常温常压下,其单质很难与其他物质反应
③单质分子中含有18个电子 ④其氢化物极易溶于水
(7)C、E和F 三种元素的氢化物中,沸点最高的氢化物的化学式是
(8)A和D 两元素金属性较强的是(填元素符号)
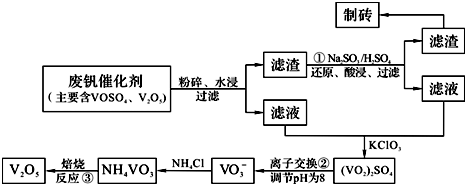
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺。己知:V可形成VO2+、VO2+、VO3-等多种离子;部分含钒物质在水中的溶解性如下表所示:
|
物质 |
VOSO4 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
|
溶解性 |
可溶 |
难溶 |
难溶 |
易溶 |

该工艺的主要流程如下:
请回答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其反应的化学方程式为 。
(2)反应①的目的是 。
(3)若用NaOH溶液调节pH,则转化②的离子方程式为 。
(4)实验室中实现反应③所需主要仪器除三脚架、泥三角、酒精灯外,必不可少的是 。
(5)V2O5为硫酸工业接触室中的重要催化剂,其催化反应为2SO2(g)+O2(g) 2SO3(g)
ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为
2SO3(g)
ΔH<0,在容积为2.0 L的密闭容器中充入2 mol SO2、1 mol O2,一定条件下达到平衡,SO3的体积分数为 。
。
①该条件下反应2SO2(g)+O2(g) 2SO3(g)
的平衡常数为_____;
2SO3(g)
的平衡常数为_____;
②下列措施能使 增大的是_____。
增大的是_____。
A.升高温度
B.保持温度和容积不变,再充入2 mol He
C.保持温度和容积不变,再充入2 mol SO2和1 mol O2
D.不用V2O5作催化剂,改用其它更高效催化剂
查看习题详情和答案>>
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
请回答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其反应的化学方程式为
| ||
| ||
(2)反应①的目的是
(3)若用NaOH溶液调节pH,则转化②的离子方程式为
(4)实验室中实现反应③所需主要仪器除三脚架、泥三角、酒精灯外,必不可少的是
(5)V2O5为硫酸工业接触室中的重要催化剂,其催化反应为2SO2(g)+O2(g)?2SO3(g)△H<0,在容积为2.0L的密闭容器中充入2mol SO2、1mol O2,一定条件下达到平衡,SO3的体积分数为
| 6 |
| 7 |
①该条件下反应2SO2(g)+O2(g)?2SO3(g)的平衡常数为
②下列措施能使
| n(SO3) |
| n(SO2) |
A.升高温度
B.保持温度和容积不变,再充入2mol He
C.保持温度和容积不变,再充入2mol SO2和1mol O2
D.不用V2O5作催化剂,改用其它更高效催化剂.
(一).对金属制品进行抗腐蚀处理,可延长其使用寿命。
以下为铝材表面处理的一种方法:

(1)碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出, 为将槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。 (填编号)
a.NH3 b.CO2 c.NaOH d.HNO3
(2)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,
阳极电极反应式为 。取少量废电解液,加入NaHCO3溶液,写出发生反应的离子方程式
(二).A—E五种元素中,除A、B外其他均为短周期元素它们的性质或原子结构如下表:
元素 元素性质或原子结构
A 单质为生活中常见的金属,该金属的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160
B 单质为生活中常见的金属,其相对原子质量比A大8
C 地壳中含量最多的金属元素
D 元素的主族序数是其所在周期序数的3倍
E E的某种原子的原子核内没有中子
(1)在高温条件下,将D、E组成的气态化合物与A的粉末充分反应,生成8gE的单质和相应的固态化合物时,放出a KJ热量,此反应的热化学方程式是
(2)A的某种氯化物溶液呈黄色,向其中通入足量SO2气体,溶液变为浅绿色,此反应的离子方程式是
(3)向2mL 0.5mol/L的ACl3溶液中加入3mL 3mol/L KF溶液,
ACl3溶液褪成无色,再加入KI溶液和CCl4振荡后静置,CCl4层不显色,
则下列说法正确的是(已知氧化性Fe3+>I2) (填字母)。
a.A3+不与I-发生反应
b.A3+与F-结合生成不与I-反应的物质
c.F-使I-的氧化性减弱
d.A3+被F-还原为A2+,使溶液中不再存在A3+
查看习题详情和答案>>
回答下列问题:
(1)M在元素周期表中的位置为
(2)Z、X两元素按原子数目比1:3和2:4构成分子A和B,A的电子式为




(3)硒(Se)是人体必需的微量元素,与W同一主族,Se原子比W原子多两个电子层,则Se的原子序数为
a.+99.7kJ?mol-1 b.+29.7kJ?mol-1
c.-20.6kJ?mol-1 d.-241.8kJ?mol-1
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q.写出阳极生成R的电极反应式: