题目内容
(2013?资阳二模)为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺.己知:V可形成VO2+、VO2+、VO3-等多种离子;部分含钒物质在水中的溶解性如下表所示:
该工艺的主要流程如下:
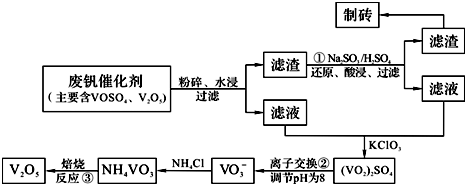
请回答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其反应的化学方程式为
(2)反应①的目的是
(3)若用NaOH溶液调节pH,则转化②的离子方程式为
(4)实验室中实现反应③所需主要仪器除三脚架、泥三角、酒精灯外,必不可少的是
(5)V2O5为硫酸工业接触室中的重要催化剂,其催化反应为2SO2(g)+O2(g)?2SO3(g)△H<0,在容积为2.0L的密闭容器中充入2mol SO2、1mol O2,一定条件下达到平衡,SO3的体积分数为
.
①该条件下反应2SO2(g)+O2(g)?2SO3(g)的平衡常数为
②下列措施能使
增大的是
A.升高温度
B.保持温度和容积不变,再充入2mol He
C.保持温度和容积不变,再充入2mol SO2和1mol O2
D.不用V2O5作催化剂,改用其它更高效催化剂.
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

请回答下列问题:
(1)工业上由V2O5冶炼金属钒常用铝热剂法,其反应的化学方程式为
3V2O5+10Al
6V+5Al2O3
| ||
3V2O5+10Al
6V+5Al2O3
.
| ||
(2)反应①的目的是
将V2O5转化为可溶的VOSO4
将V2O5转化为可溶的VOSO4
.(3)若用NaOH溶液调节pH,则转化②的离子方程式为
VO2++2OH-=VO3-+H2O
VO2++2OH-=VO3-+H2O
.(4)实验室中实现反应③所需主要仪器除三脚架、泥三角、酒精灯外,必不可少的是
坩埚
坩埚
.(5)V2O5为硫酸工业接触室中的重要催化剂,其催化反应为2SO2(g)+O2(g)?2SO3(g)△H<0,在容积为2.0L的密闭容器中充入2mol SO2、1mol O2,一定条件下达到平衡,SO3的体积分数为
| 6 |
| 7 |
①该条件下反应2SO2(g)+O2(g)?2SO3(g)的平衡常数为
1620
1620
;②下列措施能使
| n(SO3) |
| n(SO2) |
C
C
.A.升高温度
B.保持温度和容积不变,再充入2mol He
C.保持温度和容积不变,再充入2mol SO2和1mol O2
D.不用V2O5作催化剂,改用其它更高效催化剂.
分析:(1)铝热反应实质是置换反应,铝与五氧化二钒反应生成钒与氧化铝;
(2)由题意和流程图可知反应①的目的,将V2O5 转化为可溶性的VOSO4,便于分离提纯;
(3)依据流程中氢氧化钠会和VO2+之间反应来书写离子方程式;
(4)根据焙烧过程需要的仪器来回答;
(5)根据三行式计算化学反应的平衡常数,据影响化学反应速率的因素来判断三氧化硫和二氧化硫物质的量的变化情况.
(2)由题意和流程图可知反应①的目的,将V2O5 转化为可溶性的VOSO4,便于分离提纯;
(3)依据流程中氢氧化钠会和VO2+之间反应来书写离子方程式;
(4)根据焙烧过程需要的仪器来回答;
(5)根据三行式计算化学反应的平衡常数,据影响化学反应速率的因素来判断三氧化硫和二氧化硫物质的量的变化情况.
解答:解:(1)铝与五氧化二钒反应生成钒与氧化铝,反应方程式为3V2O5+10Al
6V+5Al2O3,故答案为:3V2O5+10Al
6V+5Al2O3;
(2)加入硫酸和亚硫酸钠,目的是利用氧化还原反应,用亚硫酸钠还原V2O5,将V2O5 转化为可溶性的VOSO4,便于提纯,故答案为:将V2O5转化为可溶性的VOSO4;
(3)若用NaOH溶液调节pH,氢氧化钠会和VO2+之间反应,离子方程式为:VO2++2OH-=VO3-+H2O,故答案为:VO2++2OH-=VO3-+H2O;
(4)实验室中实现反应③焙烧所需主要仪器:三脚架、泥三角、酒精灯,坩埚,故答案为:坩埚;
(5)①设二氧化硫的变化量是x,
2SO2(g)+O2(g)?2SO3(g)
初始浓度:1 0.5 0
变化浓度:x 0.5x x
平衡浓度:1-x 0.5(1-x) x
达到平衡时SO3的体积分数为
,所以
=
,解得x=0.9mol/L
所以平衡常数K=
=1620L/mol,故答案为:1620;
②A.化学平衡2SO2(g)+O2(g)?2SO3(g)△H<0,升高温度,逆向进行,所以三氧化硫的物质的量减小,二氧化硫的物质的量增加,所以比值减小,故A错误;
B.保持温度和容积不变,再充入2molHe,各组分的浓度不变,平衡不移动,所以比值不变,故B错误;
C.保持温度和容积不变,再充入2molSO2和1molO2,相当于增加压强,所以平衡正向移动,三氧化硫的物质的量增加,二氧化硫的物质的量减小,所以比值增大,故C正确;
D.不用V2O5作催化剂,改用其它更高效催化剂,也不会引起平衡的移动,所以比值不变,故D错误.
故选C.
| ||
| ||
(2)加入硫酸和亚硫酸钠,目的是利用氧化还原反应,用亚硫酸钠还原V2O5,将V2O5 转化为可溶性的VOSO4,便于提纯,故答案为:将V2O5转化为可溶性的VOSO4;
(3)若用NaOH溶液调节pH,氢氧化钠会和VO2+之间反应,离子方程式为:VO2++2OH-=VO3-+H2O,故答案为:VO2++2OH-=VO3-+H2O;
(4)实验室中实现反应③焙烧所需主要仪器:三脚架、泥三角、酒精灯,坩埚,故答案为:坩埚;
(5)①设二氧化硫的变化量是x,
2SO2(g)+O2(g)?2SO3(g)
初始浓度:1 0.5 0
变化浓度:x 0.5x x
平衡浓度:1-x 0.5(1-x) x
达到平衡时SO3的体积分数为
| 6 |
| 7 |
| x |
| 1-x+0.5(1-x)+x |
| 6 |
| 7 |
所以平衡常数K=
| c(SO3)2 |
| c(SO2)2?c(O2) |
②A.化学平衡2SO2(g)+O2(g)?2SO3(g)△H<0,升高温度,逆向进行,所以三氧化硫的物质的量减小,二氧化硫的物质的量增加,所以比值减小,故A错误;
B.保持温度和容积不变,再充入2molHe,各组分的浓度不变,平衡不移动,所以比值不变,故B错误;
C.保持温度和容积不变,再充入2molSO2和1molO2,相当于增加压强,所以平衡正向移动,三氧化硫的物质的量增加,二氧化硫的物质的量减小,所以比值增大,故C正确;
D.不用V2O5作催化剂,改用其它更高效催化剂,也不会引起平衡的移动,所以比值不变,故D错误.
故选C.
点评:本题涉及化学平衡的有关计算、铝热反应的含义以及影响化学平衡移动的因素等知识,注意知识的迁移和应用是解题的关键,难度不大.

练习册系列答案
相关题目