摘要:17.0.03molCu完全溶于HNO3.产生氮的氧化物混合气体共0.05mol.则该混合气体的平均相对分子质量可能是: A.3O B.46 C.66 D.50
网址:http://m.1010jiajiao.com/timu3_id_365322[举报]
 下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:①一般认为H2SO4浓度大于60%,就具有一定的强氧化性,越浓氧化性越强,60%以下的H2SO4主要体现的是酸性,基本上不体现强氧化性.
②温度也影响氧化性,如铜放于冷的浓H2SO4中反应不明显,如果加热就可以观察到明显现象.
③98%的浓H2SO4物质的量浓度为18.4mol/L,密度为1.84g?cm-3,根据以上信息回答:?
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3mL水,然后从分液漏斗中加98%的浓H2SO4 0.5mL,加热至沸腾,该试管中液体没有明显变化,试用数据解释原因
H2SO4溶液的质量分数为23%<60%,其氧化性不强,所以无明显现象
H2SO4溶液的质量分数为23%<60%,其氧化性不强,所以无明显现象
(2)乙同学利用所示装置直接从分液漏斗中再加浓H2SO4 10mL与铜片反应.观察到右边试管中溶液褪色,这是因为
生成具有漂白性的二氧化硫
生成具有漂白性的二氧化硫
;若把品红试液换成硝酸酸化的硝酸钡溶液,产生的现象是由白色沉淀生成
由白色沉淀生成
;在左边试管中观察到的现象除了铜粉变黑色外,还有:①
液体呈浅蓝色
液体呈浅蓝色
,原因是溶液中含有Cu2+
溶液中含有Cu2+
②有白色固体在试管底部析出,原因是
98%浓H2SO4有吸水性,生成无水CuSO4
98%浓H2SO4有吸水性,生成无水CuSO4
;(3)丙同学等乙同学实验结束后,取左试管(内有没反应完的铜)倾出上层清液于试管中来检验剩余的硫酸,他可以选择下列哪些试剂
AD
AD
(填写编号).A.锌粉 B.银粉 C.氯化钡溶液 D.碳酸氢钠溶液.
为了测定混有少量KCl杂质的明矾KAl(SO4)2?nH2O的纯度,同时测定n的值,按下列流程进行实验:

(1)晶块磨碎时使用的仪器名称
(2)若加热过程中有固体飞溅出来造成损失,则会使测得的n值偏
(3)在加热结束后,如何冷却固体?
(4)A溶液是
(5)过滤后还需将沉淀洗涤干净,洗涤方法是
(6)通过实验,测得明矾化学式中n值为12,则明矾的纯度为
%.
查看习题详情和答案>>

(1)晶块磨碎时使用的仪器名称
研钵
研钵
;(2)若加热过程中有固体飞溅出来造成损失,则会使测得的n值偏
高
高
,判断已脱水至恒重的方法是两次称量质量差不超过0.1g
两次称量质量差不超过0.1g
;(3)在加热结束后,如何冷却固体?
用坩埚钳把坩埚移到干燥器中冷却
用坩埚钳把坩埚移到干燥器中冷却
;(4)A溶液是
BaCl2
BaCl2
(填化学式),判断A溶液是否足量的方法是静置后向上层清液滴加适量A观察有无沉淀产生
静置后向上层清液滴加适量A观察有无沉淀产生
;(5)过滤后还需将沉淀洗涤干净,洗涤方法是
用玻璃棒引流加入蒸馏水至浸没过沉淀物,待水流完后重复以上操作至洗净为止
用玻璃棒引流加入蒸馏水至浸没过沉淀物,待水流完后重复以上操作至洗净为止
;(6)通过实验,测得明矾化学式中n值为12,则明矾的纯度为
| 23700m2 |
| 233m |
| 23700m2 |
| 233m |
50mL的酸式滴定管中盛有0.1mol/L的HCl溶液,溶液的凹液面最低点刻度为20.00mL.若将滴定管内的酸液全部放完,刚好中和锥形瓶内30.00mL的NaOH溶液,此碱液的浓度为( )
| A、>0.1mol/L | B、<0.1mol/L | C、=0.1mol/L | D、不能确定 |
某生欲用 2mol/LNaOH溶液配制0.1mol/LNaOH溶液100mL,请你帮他完成该实验:(1)该生应该选用的实验仪器有
(2)实验中所需量取2mol/LNaOH溶液的体积为
(3)该生把量取的NaOH溶液倒入小烧杯中加水稀释冷却后,转移到容量瓶中,即进行定容、摇匀,得到所需的溶液.该生的操作准确吗?如不准确,请你指出他操作中的错误或缺漏之处:
(4)请你说出该生定容操作应采取的具体方法
查看习题详情和答案>>
10mL量筒、玻璃棒、100mL容量瓶、胶头滴管、小烧杯
10mL量筒、玻璃棒、100mL容量瓶、胶头滴管、小烧杯
.(2)实验中所需量取2mol/LNaOH溶液的体积为
5mL
5mL
.(3)该生把量取的NaOH溶液倒入小烧杯中加水稀释冷却后,转移到容量瓶中,即进行定容、摇匀,得到所需的溶液.该生的操作准确吗?如不准确,请你指出他操作中的错误或缺漏之处:
不准确;转移完溶液后应用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液也一同转入容量瓶中.
不准确;转移完溶液后应用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液也一同转入容量瓶中.
.(4)请你说出该生定容操作应采取的具体方法
向容量瓶中注入蒸馏水至离刻度线1~2cm处,改用胶头滴管滴加蒸馏水到溶液的凹液面正好与刻度线相切
向容量瓶中注入蒸馏水至离刻度线1~2cm处,改用胶头滴管滴加蒸馏水到溶液的凹液面正好与刻度线相切
.(1)某化学课外研究小组,设计实验探究KI溶液和FeCl3溶液反应存在一定的限度.请完成相关的实验步骤和现象.
可选试剂:①0.1mol?L-1KI溶液;②0.1mol?L-1 FeCl3溶液;③FeCl2溶液;④盐酸;⑤KSCN溶液;⑥CCl4.
实验步骤:
①取5mL 0.1mol?L-1 KI溶液,再滴加5~6滴0.1mol?L-1FeCl3溶液
②充分反应后,将溶液分成三份
③取其中一份,滴加试剂CCl4,用力振荡一段时间,CCl4层出现紫红色,说明反应生成碘.
④另取一份,滴加试剂
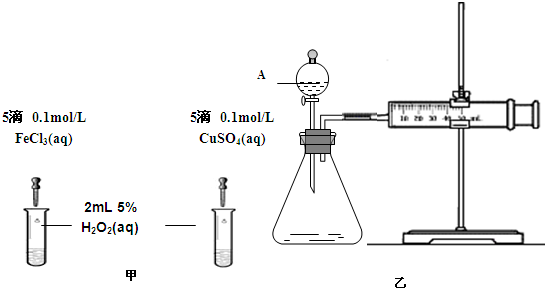
(2)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.实验中需要测量的数据是
查看习题详情和答案>>
可选试剂:①0.1mol?L-1KI溶液;②0.1mol?L-1 FeCl3溶液;③FeCl2溶液;④盐酸;⑤KSCN溶液;⑥CCl4.
实验步骤:
①取5mL 0.1mol?L-1 KI溶液,再滴加5~6滴0.1mol?L-1FeCl3溶液
②充分反应后,将溶液分成三份
③取其中一份,滴加试剂CCl4,用力振荡一段时间,CCl4层出现紫红色,说明反应生成碘.
④另取一份,滴加试剂
KSCN溶液
KSCN溶液
,现象溶液显血红色
溶液显血红色
,说明Fe3+没有反应完(或KI和FeCl3的反应有一定的限度)
Fe3+没有反应完(或KI和FeCl3的反应有一定的限度)
.(2)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察
溶液中气泡产生的速率
溶液中气泡产生的速率
,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3 更为合理,其理由是排除氯离子的干扰
排除氯离子的干扰
.②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.实验中需要测量的数据是
收集40mL气体所需的时间
收集40mL气体所需的时间
.