摘要:19.某工厂用C aSO4.H2O.NH3.CO2制备(NH4)2SO4.其工艺流程如下: 下列推断不合理的是 ( ) A.往甲中通CO2有利(NH4)2SO4生成 B.生在1 mol(NH4)2SO4至少消耗2molNH3 C.CO2可被循环使用 D.直接蒸干滤液能得到纯净(NH4)2SO4 100080 20.右表为元素周期表短周期的一部分.下列有关A.B.C.D四种元素的叙述不正确的是 ( ) A B C D A.原子半径大小比较为D>A>B>C B.生成的氢化物分子间均可形成氢键 C.A与C形成的阴离子可能有AC.A2C D.A.B.C.D的单质常温下均不导电
网址:http://m.1010jiajiao.com/timu3_id_364770[举报]
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路(已知发生的反应为 2FeCl3+Cu=2FeCl2+CuCl2).课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取100mL废液加入足量的AgNO3溶液,生成沉淀 86.1g.(2)另取100mL废液放入铜片充分反应,铜片质量减少了2.56g.下列关于原废液组成的判断错误的是( )
| A、c(Fe2+):c(Fe 3+):c(Cu2+)=2:1:1 | B、c(Fe2+):c(Cu2+)=2:1 | C、一定含有Fe2+、Fe3+、Cu2+、Clˉ | D、c(Clˉ)=6mol/L,c(Fe2+)=1.2mol/L |
(2010?南宁一模)已知A、B、C、D为四种单质,常温时,A、B是气体,C、D是固体且D显淡黄色.E、F、G、H、I为五种化合物,E为气体且极易溶于水成为无色溶液,F不溶于水,G溶于水得黄棕色溶液.这九种物质间反应的转化关系如图所示:

(I)写出四种单质的化学式
A
(2)用电子式表示E的形成过程
 ;化台物I的晶体类型为
;化台物I的晶体类型为
(3)写出G+I→H+D+E的化学方程式
(4)某工厂用B制漂白粉.为测定该工厂制得的漂白粉中有效成分的含量,兴趣小组的同学进行了如下实验:称取漂白粉样品2.0g,研磨后溶解,配置成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为:
查看习题详情和答案>>

(I)写出四种单质的化学式
A
H2
H2
,BCl2
Cl2
,CFe
Fe
,DS
S
.(2)用电子式表示E的形成过程


分子晶体
分子晶体
其空间构型为V型
V型
.(3)写出G+I→H+D+E的化学方程式
2FeCl3+H2S═2FeCl2+S↓+2HCl
2FeCl3+H2S═2FeCl2+S↓+2HCl
.(4)某工厂用B制漂白粉.为测定该工厂制得的漂白粉中有效成分的含量,兴趣小组的同学进行了如下实验:称取漂白粉样品2.0g,研磨后溶解,配置成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为:
2I-+ClO-+2H+=I2+Cl-+H2O
2I-+ClO-+2H+=I2+Cl-+H2O
.静置,待完全反应后,用0.1mol?L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00ml.则该漂白粉样品中有效成分的质量分数为35.75%
35.75%
(保留到小数点后两位).(2008?佛山一模)某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2和Zn(干电池原料):
已知①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.②IV中的电解反应式为MnSO4+ZnSO4+2H2O
MnO2+Zn+2H2SO4.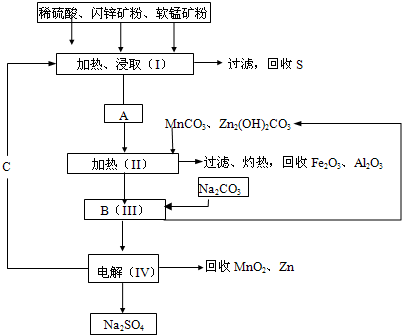
(1)A中属于还原产物的是
(2)MnCO3、Zn2(OH)2CO3的作用是
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是
(5)要从Na2SO4溶液中得到芒硝(Na2SO4?10H2O),需进行的操作有蒸发浓缩、
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是
查看习题详情和答案>>
已知①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.②IV中的电解反应式为MnSO4+ZnSO4+2H2O
| 电解 |

(1)A中属于还原产物的是
MnSO4
MnSO4
.(2)MnCO3、Zn2(OH)2CO3的作用是
调节溶液的pH,使Fe3+和Al3+生成沉淀
调节溶液的pH,使Fe3+和Al3+生成沉淀
;II需要加热的原因是加速沉淀生成,防止胶体出现,并使形成胶体的氢氧化铝和氢氧化铁也生成沉淀
加速沉淀生成,防止胶体出现,并使形成胶体的氢氧化铝和氢氧化铁也生成沉淀
;C的化学式是H2SO4
H2SO4
.(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是
硫、氧化铁、氧化铝
硫、氧化铁、氧化铝
.(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是
碳酸钠、硫酸
碳酸钠、硫酸
.(5)要从Na2SO4溶液中得到芒硝(Na2SO4?10H2O),需进行的操作有蒸发浓缩、
冷却结晶
冷却结晶
、过滤、洗涤、干燥等.(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是
1.03
1.03
.某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路.课外活动小组为确认生产后的废液的组成,进行如下实验:
(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 0.06mol
(2)另取10mL废液放入铜片充分反应,铜片质量减少了0.256g.
下列关于原废液组成的判断正确的是( )
(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 0.06mol
(2)另取10mL废液放入铜片充分反应,铜片质量减少了0.256g.
下列关于原废液组成的判断正确的是( )
| A、一定只有Fe2+、Fe3+、Cl- | B、c(Fe2+):c(Cu2+)=1:3 | C、c(Fe2+):c(Fe3+)=3:2 | D、c(Cl-)=6mol/L,c(Fe2+)=1.2mol/L |