摘要:4.由IIIA族元素A和VI族元素B组成的阴离子结构如下图.所带电荷数x y z依次为 ----------------------------------- X- B A.2.3.4 B.2.3.2 C.5.6.4 D.4.3.2
网址:http://m.1010jiajiao.com/timu3_id_363647[举报]
由第IIA族金属单质A和第IIIA族金属单质B组成的混合物1.29g ,用过量的盐酸完全溶解后生成的氢气在标准状况下的体积为1.456L.若A和B的原子量之比为8:9,混合物中A和B的原子个数比为2:3。
(1)第IIA、第IIIA族元素的最外层电子数分别为 。
(2)等物质的量A、B分别与足量稀硫酸反应生成的氢气在相同状况下的体积比为 。
(3)B与稀硫酸反应的离子方程式为 。(B用具体的元素符号表示)
(4)填写下面括号中内容:
解:设A、B的相对原子量分别为8M、9M;A、B的物质的量分别为2x、 3x。
A+2HCl==ACl2+H2;2B+6HCl==2BCl3+3H2
2x 2x 3x ( )
2x+( )=( )/22.4=0.065( )
( )×8M+( )×9M=1.29
则A的相对原子量为( );B的相对原子量为( )。
查看习题详情和答案>>下列有关叙述中正确的是( )
A.因为液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
B.若IIA族某元素的原子序数为m,则同周期IIIA族元素的原子序数有可能为m+10
C.S8和NO2都是共价化合物,NH4Cl和CaC2都是离子化合物
D.由原子间通过共价键而形成的晶体具有较高熔沸点及较大的硬度
查看习题详情和答案>>下表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:
(1)f元素在周期表中的位置是
(2)b元素形成的同素异形体的晶体类型可能是(填序号)
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)e在空气中燃烧的产物所含化学键的类型为
(4)化合物ca3的电子式为
 ,ca3的催化氧化反应的化学方程式为
,ca3的催化氧化反应的化学方程式为
(5)a、c、d中的两种元素可组成具有10电子的多种分子和离子,写出其中两种离子反应生成两种分子的离子方程式
(6)由a、b、c、g四种元素中的三种元素组成的某种化合物,可与其中的第四种元素的单质发生反应,该反应的化学方程式为
查看习题详情和答案>>
| a | |||||||
| b | c | d | |||||
| e | f | g | |||||
第三
第三
周期第IIIA
第IIIA
族.(2)b元素形成的同素异形体的晶体类型可能是(填序号)
①③
①③
.①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)e在空气中燃烧的产物所含化学键的类型为
离子键、
离子键、
、共价键
共价键
.(4)化合物ca3的电子式为


4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
,若有1.25mol 电子发生转移,则参加反应的ca3的体积为
| ||
| △ |
5.6
5.6
L(标准状况).(5)a、c、d中的两种元素可组成具有10电子的多种分子和离子,写出其中两种离子反应生成两种分子的离子方程式
NH4++OH-
NH3↑+H2O
| ||
NH4++OH-
NH3↑+H2O
.
| ||
(6)由a、b、c、g四种元素中的三种元素组成的某种化合物,可与其中的第四种元素的单质发生反应,该反应的化学方程式为
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
.
| ||
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题
Ⅰ.(1)请画出元素⑧的离子结构示意图 .
(2)元素⑦中质子数和中子数相等的同位素符号是 .
(3)④、⑤、⑦的原子半径由大到小的顺序为 .
(4)⑦和⑧的最高价氧化物对应水化物的酸性强弱为 > .
(5)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为 .
(6)周期表中,同一主族元素化学性质相似;同时有些元素和它在周期表中左上方或右下方的另一主族元素的化学性质也相似,如Li与Mg,这称为对角线规则.上表中与铍的化学性质相似的元素有(填元素名称) .铍的最高价氧化物对应水化物属于两性化合物,该化合物的化学式是 ,能够说明其具有两性的反应离子方程式为: ; .
Ⅱ.由表中①~⑧中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),试回答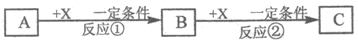
(1)若X是强氧化性单质,则A不可能是 (填序号).
a.S b.N2 c.Na d.Mg e.Al
(2)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属阳离子的化学试剂 ,现象是 ;又知在酸性溶液中该金属阳离子能被双氧水氧化,写出该反应的离子方程式: .
(3)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为 ,写出A与C两溶液反应的离子方程式: .
查看习题详情和答案>>
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)元素⑦中质子数和中子数相等的同位素符号是
(3)④、⑤、⑦的原子半径由大到小的顺序为
(4)⑦和⑧的最高价氧化物对应水化物的酸性强弱为
(5)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为
(6)周期表中,同一主族元素化学性质相似;同时有些元素和它在周期表中左上方或右下方的另一主族元素的化学性质也相似,如Li与Mg,这称为对角线规则.上表中与铍的化学性质相似的元素有(填元素名称)
Ⅱ.由表中①~⑧中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),试回答

(1)若X是强氧化性单质,则A不可能是
a.S b.N2 c.Na d.Mg e.Al
(2)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属阳离子的化学试剂
(3)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为
(2011?天津模拟)已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的负价代数和为6.M与其他物质的转化关系如图(部分产物已略去):
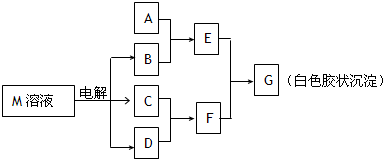
(1)若A是与X、Y同周期的一种常见金属,则A元素在周期表中的位置是
(2)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素原子结构示意图为
 ,写出E与F反应的离子方程式
,写出E与F反应的离子方程式
(3)B的电子式为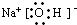
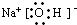 ,其中的化学键为
,其中的化学键为
 .
.
(4)工业上用电解物质M的产物之一氧化有毒含氰(CN-)碱性废水,得到无毒的N2、CO2等.写出此反应的离子反应方程式
查看习题详情和答案>>

(1)若A是与X、Y同周期的一种常见金属,则A元素在周期表中的位置是
第三
第三
周期第IIIA
第IIIA
族,写出A与B溶液反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
.(2)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素原子结构示意图为


2H++SiO32-=H2SiO3↓
2H++SiO32-=H2SiO3↓
.(3)B的电子式为
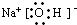
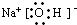
离子键和共价键
离子键和共价键
.用电子式表示M的形成过程

(4)工业上用电解物质M的产物之一氧化有毒含氰(CN-)碱性废水,得到无毒的N2、CO2等.写出此反应的离子反应方程式
5Cl2+2CN-+8OH-=10Cl-+N2+2CO2+4H2O
5Cl2+2CN-+8OH-=10Cl-+N2+2CO2+4H2O
.