网址:http://m.1010jiajiao.com/timu3_id_363559[举报]
(1)草酸亚铁晶体(FeC2O4?2H2O)的制备

①现有烧杯、玻璃棒、药匙、滤纸、托盘天平、胶头滴管等实验仪器,为配制上述两种溶液,缺少的玻璃仪器为
②过滤、洗涤过程中,检验草酸亚铁晶体是否洗净的方法是
③分析上述草酸亚铁晶体的制备方案,可推FeC2O4?2H2O具备的性质是
a.在水中溶解度较小 b.不稳定,受热易分解
c.白色固体 d.易被空气氧化
(2)纳米铁粉的制备
将一根长度约为12cm~14cm的玻璃管在酒精喷灯上烧制成如图所示形状,向其中加入黄色草酸亚铁晶体.再将管口部分加热拉细,然后在酒精喷灯上均匀加热.当草酸亚铁粉末受热完全变黑,立即将管口拉细的部分放在火焰烧熔封闭,
 这样便得到了高纯度的纳米铁粉.
这样便得到了高纯度的纳米铁粉.①制备纳米铁粉,反应的化学方程式为
| ||
| ||
②实验前无需排尽装置中的空气,原因是
(1)A的化学式为
(2)该盐含有的金属元素是
(3)通过计算推断该盐的化学式. 查看习题详情和答案>>
①C+G→B+H,放出大量的热,该反应曾应用于铁轨的焊接,G物质是磁铁矿的主要成分;
②I是一种常见的温室气体,它和E发生反应:2E+I→2F+D,F中E元素的质量分数为60%.
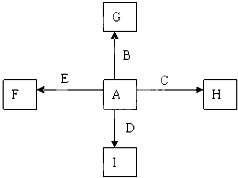
回答下列问题.
(1)反应①的化学方程式是
(2)化合物I中所存在的化学键是
(3)称取11.9g B、C、E的混合物,用过量的NaOH溶液溶解后,过滤、称量剩余固体质量为9.2g,另取等质量的B、C、E的混合物用足量的稀硝酸完全溶解,共收集到标况下气体6.72L,向剩余的混合液中加入过量的NaOH溶液,所得沉淀的质量为
A.27.2g B.7.8g C.2.7g D.19.4g
(4)C与过量的NaOH溶液反应的离子方程式是:
(5)将G溶于过量的稀盐酸中,欲检验其中的Fe3+的方案是
A.滴加KSCN溶液,溶液变血红色
B.加铁粉,溶液变浅绿色
C.滴入酸性KMnO4溶液,迅速褪色
D.滴加NaOH溶液,有白色沉淀且迅速变成灰绿色最后转化为红褐色.
下图中A、B、C、D、E为单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知①C+G→B+H,放出大量的热,该反应曾应用于铁轨的焊接,G物质是磁铁矿的主要成分,②I是一种常见的温室气体,它和E发生反应:2E+I→2F+D,F中E元素的质量分数为60%,回答下列问题(每空2分,共12分)

(1)反应①的化学方程式是
(2)化合物I中所存在的化学键是 键 (填“离子”或 “极性”或“非极性”)
(3)称取11.9gB、C、E的混合物,用过量的NaOH溶液溶解后,过滤、称量剩余固体质量为9.2g,另取等质量的B、C、E的混合物用稀硝酸完全溶解,共收集到标况下气体6.72L,向剩余的混合液,加入过量的NaOH溶液使其中的金属离子完全沉淀,则沉淀的质量为( )
A.27.2g B.7.8g C.2.7g D.19.4g
(4)C与过量的NaOH溶液反应的离子方程式是:
(5)将G溶于过量的稀盐酸中,欲检验其中的Fe3+的方案是 ,欲检验其中的Fe2+的方案是
A.滴加KSCN溶液,溶液变血红色
B.加铁粉,溶液变浅绿色
C.滴入酸性KMnO4溶液,迅速褪色
D.滴加NaOH溶液,有白色沉淀且迅速变成灰绿色最后转化为红褐色
查看习题详情和答案>>
下图中A、B、C、D、E为单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知①C+G→B+H,放出大量的热,该反应曾应用于铁轨的焊接,G物质是磁铁矿的主要成分,②I是一种常见的温室气体,它和E发生反应:2E+I→2F+D,F中E元素的质量分数为60%,回答下列问题(每空2分,共12分)
(1)反应①的化学方程式是
(2)化合物I中所存在的化学键是 键(填“离子”或“极性”或“非极性”)
(3)称取11.9gB、C、E的混合物,用过量的NaOH溶液溶解后,过滤、称量剩余固体质量为9.2g,另取等质量的B、C、E的混合物用稀硝酸完全溶解,共收集到标况下气体6.72L,向剩余的混合液,加入过量的NaOH溶液使其中的金属离子完全沉淀,则沉淀的质量为( )
A.27.2g B.7.8g C.2.7g D.19.4g
(4)C与过量的NaOH溶液反应的离子方程式是:
(5)将G溶于过量的稀盐酸中,欲检验其中的Fe3+的方案是 ,欲检验其中的Fe2+的方案是
A.滴加KSCN溶液,溶液变血红色
B.加铁粉,溶液变浅绿色
C.滴入酸性KMnO4溶液,迅速褪色
D.滴加NaOH溶液,有白色沉淀且迅速变成灰绿色最后转化为红 褐色
褐色