摘要:如图3是氯化钠的晶体结构示意图.小圆圈是晶体中的Na+或Cl-所处的位置.晶体中 .在每个Na+周围.与它最接近且距离相等的Na+离子共有:( ) A.4个 B.6个 C.8个 D.12个 知识点:晶体的构成微粒及微粒间的空间排列规律 能力点:分析推断能力.想象 能力及三维空间思维能力.创新思维能力
网址:http://m.1010jiajiao.com/timu3_id_363508[举报]
物质的结构是决定物质性质的重要因素。请回答下列问题:
(1)基态Ni原子核外电子排布式为____________;第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是_______________。
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分为0.069nm和0.078nm,则熔点NiO____________FeO(填“<”或“>”);NiO晶胞中Ni2+的配位数为____________。
(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4+2N2H4=3N2+4H2O,若该反应中有4molN—H键断裂,形成的 键有________mol。
键有________mol。
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图1所示.该合金化学式为 ;

(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟Ni2+反应可生成鲜红色沉淀,其结构如图2所示:

①该结构中,碳碳之间共价键是σ键,碳氮之间共价键是 ,氮镍之间形成化学键是 ;
②该结构中,氧氢之间除共价键外还可存在 ;
③该结构中,碳原子杂化轨道有
(1)基态Ni原子核外电子排布式为____________;第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是_______________。
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分为0.069nm和0.078nm,则熔点NiO____________FeO(填“<”或“>”);NiO晶胞中Ni2+的配位数为____________。
(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4+2N2H4=3N2+4H2O,若该反应中有4molN—H键断裂,形成的
 键有________mol。
键有________mol。(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图1所示.该合金化学式为 ;

(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟Ni2+反应可生成鲜红色沉淀,其结构如图2所示:

①该结构中,碳碳之间共价键是σ键,碳氮之间共价键是 ,氮镍之间形成化学键是 ;
②该结构中,氧氢之间除共价键外还可存在 ;
③该结构中,碳原子杂化轨道有
(1)下列有关晶体的叙述中错误的是
A.石英晶体中的硅原子以sp2杂化方式与周围的氧原子形成共价键
B.氯化钠晶体中每个Na+或Cl-周围紧邻的有6个Cl-或Na+
C.在CsCl晶体中每个Cs+周围紧邻的有8个Cl-,而和每个Cl-等距离紧邻的也有8个Cs+
D.在面心立方密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子
(2)已知MgO的晶体结构属于NaCl型.某同学画出的MgO晶胞结构示意图如图1所示,请改正图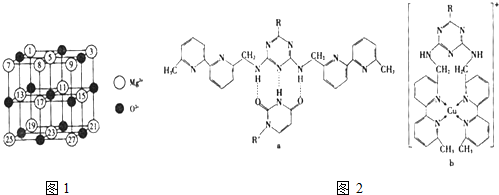
中错误: .(用文字表述)
(3)第三周期部分元素氟化物的熔点见下表:
解释表中氟化物熔点差异的原因: .
(4)人工模拟是当前研究的热点.有研究表明,化合物X可用于研究模拟酶,当其结合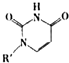 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:
分析a和b中微粒间的相互作用(包括化学键和分子间相互作用)的差异,试指出
其不同点:a中含 ,b中含 .(用“氢键”、“配位键”、“极性键”、“非极性键”等填空)
查看习题详情和答案>>
A.石英晶体中的硅原子以sp2杂化方式与周围的氧原子形成共价键
B.氯化钠晶体中每个Na+或Cl-周围紧邻的有6个Cl-或Na+
C.在CsCl晶体中每个Cs+周围紧邻的有8个Cl-,而和每个Cl-等距离紧邻的也有8个Cs+
D.在面心立方密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子
(2)已知MgO的晶体结构属于NaCl型.某同学画出的MgO晶胞结构示意图如图1所示,请改正图

中错误:
(3)第三周期部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
(4)人工模拟是当前研究的热点.有研究表明,化合物X可用于研究模拟酶,当其结合
 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:分析a和b中微粒间的相互作用(包括化学键和分子间相互作用)的差异,试指出
其不同点:a中含
常见元素A、B、C、D,其原子结构的相关信息如下表:
请回答下列问题:
(1)A的原子结构示意图是 ;D元素位于周期表第 周期 族.
(2)在由B和A形成的众多分子中,只要B原子的成键轨道满足 (填字母序号),分子中所有的原子就有可能在同一个平面内.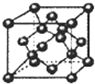
A.Sp3 或Sp2 杂化轨道 B.sp3 或sp 杂化轨道 C.sp 或sp2 杂化轨道
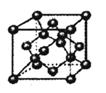
(3)如图,在B晶体的一个晶胞中含有 个B原子.
(4)制备C2A4的方法是用次氯酸钠(NaClO)溶液氧化过量的CA3.
①CA3分子是 (填“极性”或“非极性”)分子.
②写出制备C2A4的总反应方程式
(5)DC13晶体溶于水溶液呈酸性,其原因是(用离子方程式表示): .
查看习题详情和答案>>
| 元素 | 相关信息 |
| A | A原子的核外电子总数等于其基态电子层数 |
| B | B原子的最外层电子数是次外层电子数的2倍 |
| C | C的基态原子L电子层中有3个未成对电子 |
| D | D的外围电子层排布为(n+1)d3n(n+2)sn |
(1)A的原子结构示意图是
(2)在由B和A形成的众多分子中,只要B原子的成键轨道满足

A.Sp3 或Sp2 杂化轨道 B.sp3 或sp 杂化轨道 C.sp 或sp2 杂化轨道
(3)如图,在B晶体的一个晶胞中含有
(4)制备C2A4的方法是用次氯酸钠(NaClO)溶液氧化过量的CA3.
①CA3分子是
②写出制备C2A4的总反应方程式
(5)DC13晶体溶于水溶液呈酸性,其原因是(用离子方程式表示):
常见元素A、B、C、D,其原子结构的相关信息如下表:
元素 相关信息
A A原子的核外电子总数等于其基态电子层数
B B原子的最外层电子数是次外层电子数的2倍
C C的基态原子L电子层中有3个未成对电子
D D的外围电子层排布为(n+1)d3n(n+2)sn
请回答下列问题:
(1)A的原子结构示意图是_______;D元素位于周期表第______周期 ______族。
(2)在由B和A形成的众多分子中,只要B原子的成键轨道满足______(填字母序号),分子中所有的原子就有可能在同一个平面内。
A.sp3 或sp2 杂化轨道
B.sp3 或sp 杂化轨道
C.sp 或sp2 杂化轨道
(3)如图,在B晶体的一个晶胞中含有______个B原子。

(4)制备C2A4的方法是用次氯酸钠(NaClO)溶液氧化过量的CA3。
①CA3分子是______(填“极性”或“非极性”)分子。
②写出制备C2A4的总反应方程式____________
(5)DC13晶体溶于水溶液呈酸性,其原因是(用离子方程式表示):______________________________
查看习题详情和答案>>
常见元素A、B、C、D,其原子结构的相关信息如下表:
请回答下列问题:
(1)A的原子结构示意图是_______;D元素位于周期表第______周期 ______族。
(2)在由B和A形成的众多分子中,只要B原子的成键轨道满足______(填字母序号),分子中所有的原子就有可能在同一个平面内。
A.sp3或sp2杂化轨道
B.sp3或sp杂化轨道
C.sp或sp2杂化轨道
(3)如图,在B晶体的一个晶胞中含有______个B原子。
(4)制备C2A4的方法是用次氯酸钠(NaClO)溶液氧化过量的CA3。
①CA3分子是______(填“极性”或“非极性”)分子。
②写出制备C2A4的总反应方程式____________
(5)DC13晶体溶于水溶液呈酸性,其原因是(用离子方程式表示):______________________________
| 元素 | 相关信息 |
| A | A原子的核外电子总数等于其基态电子层数 |
| B | B原子的最外层电子数是次外层电子数的2倍 |
| C | C的基态原子L电子层中有3个未成对电子 |
| D | D的外围电子层排布为(n+1)d3n(n+2)sn |
请回答下列问题:
(1)A的原子结构示意图是_______;D元素位于周期表第______周期 ______族。
(2)在由B和A形成的众多分子中,只要B原子的成键轨道满足______(填字母序号),分子中所有的原子就有可能在同一个平面内。
A.sp3或sp2杂化轨道
B.sp3或sp杂化轨道
C.sp或sp2杂化轨道
(3)如图,在B晶体的一个晶胞中含有______个B原子。

(4)制备C2A4的方法是用次氯酸钠(NaClO)溶液氧化过量的CA3。
①CA3分子是______(填“极性”或“非极性”)分子。
②写出制备C2A4的总反应方程式____________
(5)DC13晶体溶于水溶液呈酸性,其原因是(用离子方程式表示):______________________________