题目内容
(1)下列有关晶体的叙述中错误的是A.石英晶体中的硅原子以sp2杂化方式与周围的氧原子形成共价键
B.氯化钠晶体中每个Na+或Cl-周围紧邻的有6个Cl-或Na+
C.在CsCl晶体中每个Cs+周围紧邻的有8个Cl-,而和每个Cl-等距离紧邻的也有8个Cs+
D.在面心立方密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子
(2)已知MgO的晶体结构属于NaCl型.某同学画出的MgO晶胞结构示意图如图1所示,请改正图
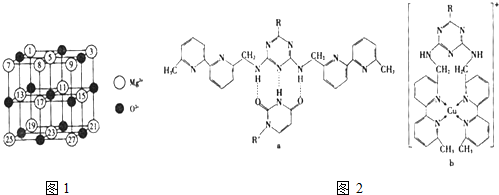
中错误:
(3)第三周期部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
(4)人工模拟是当前研究的热点.有研究表明,化合物X可用于研究模拟酶,当其结合
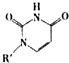 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:分析a和b中微粒间的相互作用(包括化学键和分子间相互作用)的差异,试指出
其不同点:a中含
分析:(1)A.根据石英晶体中的硅原子与氧原子间共价键数判断;
B.根据氯化钠晶体的晶胞分析;
C.根据CsCl晶体的晶胞分析;
D.面心立方密堆积的金属晶体的配位数为12;
(2)根据氯化钠的晶胞结构知,氧化镁中镁原子和镁原子处于小正方形的对角线上;
(3)根据氟化物的熔点与晶体类型的关系判断,离子晶体的熔点较高,分子晶体的熔点较低;
(4)a中O与H、N与H间形成氢键,b中N与Cu间形成配位键.
B.根据氯化钠晶体的晶胞分析;
C.根据CsCl晶体的晶胞分析;
D.面心立方密堆积的金属晶体的配位数为12;
(2)根据氯化钠的晶胞结构知,氧化镁中镁原子和镁原子处于小正方形的对角线上;
(3)根据氟化物的熔点与晶体类型的关系判断,离子晶体的熔点较高,分子晶体的熔点较低;
(4)a中O与H、N与H间形成氢键,b中N与Cu间形成配位键.
解答:解:(1)A.石英晶体中的硅原子与氧原子间形成4个共价键数,所以Si原子的价层电子对数为4,属于sp3杂化,故A错误;
B.由氯化钠晶体的晶胞可知,氯化钠晶体中每个Na+或Cl-周围紧邻的有6个Cl-或Na+,故B正确;
C.由氯化铯体的晶胞可知,CsCl晶体中每个Cs+周围紧邻的有8个Cl-,而和每个Cl-等距离紧邻的也有8个Cs+,故C正确;
D.面心立方密堆积的金属晶体的配位数为12,即金属晶体中,每个金属原子周围紧邻的有12个金属原子,故D错误;
故答案为:AD;
(2)根据氯化钠的晶胞结构知,氧化镁中镁原子和镁原子处于小正方形的对角线上,根据图象知,⑧应该为黑色,故答案为:⑧应为黑色;
(3)离子晶体的熔点较高,分子晶体的熔点较低,NaF与MgF2为离子晶体,SiF4为分子晶体,所以NaF与MgF2远比SiF4熔点要高,又因为MgF2离子电荷数比NaF大,离子核间距比NaF小,所以MgF2的离子键强度大于NaF的离子键强度,故MaF2的熔点大于NaF,
故答案为:NaF与MgF2为离子晶体,SiF4为分子晶体,所以NaF与MgF2远比SiF4熔点高,又因为MgF2离子电荷数比NaF大,离子核间距比NaF小,故MgF2的熔点大于NaF;
(4)根据图片知,a中O与H、N与H间形成氢键,b中N与Cu间形成配位键,即a中微粒间的相互作用还有氢键,b中微粒间的相互作用还有配位共价键,
故答案为:氢键;配位键.
B.由氯化钠晶体的晶胞可知,氯化钠晶体中每个Na+或Cl-周围紧邻的有6个Cl-或Na+,故B正确;
C.由氯化铯体的晶胞可知,CsCl晶体中每个Cs+周围紧邻的有8个Cl-,而和每个Cl-等距离紧邻的也有8个Cs+,故C正确;
D.面心立方密堆积的金属晶体的配位数为12,即金属晶体中,每个金属原子周围紧邻的有12个金属原子,故D错误;
故答案为:AD;
(2)根据氯化钠的晶胞结构知,氧化镁中镁原子和镁原子处于小正方形的对角线上,根据图象知,⑧应该为黑色,故答案为:⑧应为黑色;
(3)离子晶体的熔点较高,分子晶体的熔点较低,NaF与MgF2为离子晶体,SiF4为分子晶体,所以NaF与MgF2远比SiF4熔点要高,又因为MgF2离子电荷数比NaF大,离子核间距比NaF小,所以MgF2的离子键强度大于NaF的离子键强度,故MaF2的熔点大于NaF,
故答案为:NaF与MgF2为离子晶体,SiF4为分子晶体,所以NaF与MgF2远比SiF4熔点高,又因为MgF2离子电荷数比NaF大,离子核间距比NaF小,故MgF2的熔点大于NaF;
(4)根据图片知,a中O与H、N与H间形成氢键,b中N与Cu间形成配位键,即a中微粒间的相互作用还有氢键,b中微粒间的相互作用还有配位共价键,
故答案为:氢键;配位键.
点评:本题考查了物质结构和性质的有关知识,涉及物质熔点高低的影响因素、晶胞结构等知识点,同时考查学生的空间想象能力、分析问题及解决问题能力,难度中等.

练习册系列答案
相关题目
下列有关晶体的说法错误的是( )
| A、氯化钠晶体中,每个晶胞中平均含有4个钠离子和4个氯离子 | B、在金刚石晶体中,1 mol碳原子形成2 mol碳碳共价键 | C、只有金属Po的晶体采取简单立方堆积,其空间利用率最高 | D、在干冰晶体中,每一个二氧化碳分子周围有12个二氧化碳分子紧密相邻 |