摘要:H2S的体积至少为75mL.至多为90mL.
网址:http://m.1010jiajiao.com/timu3_id_363398[举报]
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图1表示该反应进行过程中能量(单位为kJ?mol-1)的变化.
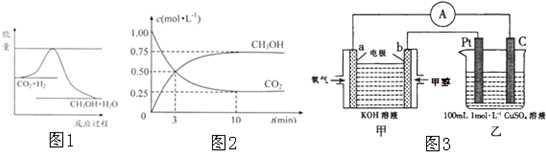
(1)关于该反应的下列说法中,正确的是
A.△H>0,△S>0; B.△H>0,△S<0;
C.△H<0,△S<0; D.△H<0,△S>0.
(2)该反应平衡常数K的表达式为
.
(3)温度降低,平衡常数K
(4)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时问变化如图2所示.从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2):
(5)下列措施中能使(4)中n(CH3OH)/n(CO2)增大的有
A.升高温度;
B.加入催化剂;
C.将H2O(g)从体系中分离;
D.再充入1molCO2和3molH2;
E.充入He(g),使体系总压强增大.
(6)生成的甲醇可设计为燃料电池,如图3现有甲装置为原电池,乙装置为电解池.
①b电极上发生的电极反应式为:
②若甲中有0.1mol CH3OH参加反应,则乙装置中生成的气体在标准状况下的体积共为
查看习题详情和答案>>

(1)关于该反应的下列说法中,正确的是
C
C
.A.△H>0,△S>0; B.△H>0,△S<0;
C.△H<0,△S<0; D.△H<0,△S>0.
(2)该反应平衡常数K的表达式为
| c(CH3OH).c(H2O) |
| c(CO2).c3(H2) |
| c(CH3OH).c(H2O) |
| c(CO2).c3(H2) |
(3)温度降低,平衡常数K
增大
增大
(填“增大”、“不变”或“减小”).(4)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时问变化如图2所示.从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2):
0.225
0.225
mol?L-1?min-1.(5)下列措施中能使(4)中n(CH3OH)/n(CO2)增大的有
CD
CD
.A.升高温度;
B.加入催化剂;
C.将H2O(g)从体系中分离;
D.再充入1molCO2和3molH2;
E.充入He(g),使体系总压强增大.
(6)生成的甲醇可设计为燃料电池,如图3现有甲装置为原电池,乙装置为电解池.
①b电极上发生的电极反应式为:
CH3OH-6e-+8OH-=CO32-+6H2O
CH3OH-6e-+8OH-=CO32-+6H2O
.②若甲中有0.1mol CH3OH参加反应,则乙装置中生成的气体在标准状况下的体积共为
7.84
7.84
L.实验室为完成某一实验,需用240mL0.1mol/L的稀盐酸,现用11.8mol/L的浓盐酸配制,填空并请回答下列问题:
(1)配制完成某一实验所需0.1mol/L的盐酸溶液,选用
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响):没有进行A操作
(4)1.06g Na2CO3与足量所配制的盐酸反应,生成CO2气体在标准状况下的体积是
查看习题详情和答案>>
(1)配制完成某一实验所需0.1mol/L的盐酸溶液,选用
250
250
mL容量瓶,应量取浓盐酸体积为2.1
2.1
mL,除容量瓶外还需要的其它仪器有10ml量筒
10ml量筒
、烧杯
烧杯
、玻璃棒
玻璃棒
、胶头滴管
胶头滴管
等.(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)
B、C、A、F、E、D
B、C、A、F、E、D
.A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响):没有进行A操作
偏低
偏低
;加蒸馏水时不慎超过了刻度偏低
偏低
;定容时俯视偏高
偏高
.(4)1.06g Na2CO3与足量所配制的盐酸反应,生成CO2气体在标准状况下的体积是
0.224
0.224
升.需所配制的盐酸的体积至少为200
200
毫升才为足量.工业接触法制硫酸的流程如图所示:

(1)写出沸腾炉中发生反应的化学方程式:
(2)从沸腾炉出来的气体经净化干燥处理后进入接触室,其气体体积组成:SO2 7%,O2 11%,N2 82%.从接触室出来的气体中SO3 的体积分数为7%,则SO2的转化率为
(3)接触室采用常压而不采用高压的原因是
(4)在吸收塔中用98.3%的浓硫酸吸收SO3 ,而不是用水吸收SO3 的原因是
每100g SO3 与H2O完全反应放出热量162.9kJ,该反应的热化学方程式为
(5)某硫酸厂每天用含FeS2 60%的黄铁矿500t生产硫酸,如果在沸腾炉内损失5%的硫,SO2 的转化率为90%.每天能生产98%的硫酸
查看习题详情和答案>>

(1)写出沸腾炉中发生反应的化学方程式:
4FeS2+11O2
2Fe2O3+8SO2
| ||
4FeS2+11O2
2Fe2O3+8SO2
.
| ||
(2)从沸腾炉出来的气体经净化干燥处理后进入接触室,其气体体积组成:SO2 7%,O2 11%,N2 82%.从接触室出来的气体中SO3 的体积分数为7%,则SO2的转化率为
96.6%
96.6%
.(3)接触室采用常压而不采用高压的原因是
常压时SO2的转化率已经很高,采用高压对SO2的转化率提高不多,却会大大增加设备成本
常压时SO2的转化率已经很高,采用高压对SO2的转化率提高不多,却会大大增加设备成本
.(4)在吸收塔中用98.3%的浓硫酸吸收SO3 ,而不是用水吸收SO3 的原因是
SO3与水反应放出大量的热,容易形成酸雾,不利于SO3吸收
SO3与水反应放出大量的热,容易形成酸雾,不利于SO3吸收
.每100g SO3 与H2O完全反应放出热量162.9kJ,该反应的热化学方程式为
SO3(g)+H2O(l)=H2SO4(l)△H=-130.3KJ/mol
SO3(g)+H2O(l)=H2SO4(l)△H=-130.3KJ/mol
.(5)某硫酸厂每天用含FeS2 60%的黄铁矿500t生产硫酸,如果在沸腾炉内损失5%的硫,SO2 的转化率为90%.每天能生产98%的硫酸
427.5
427.5
t.