��Ŀ����
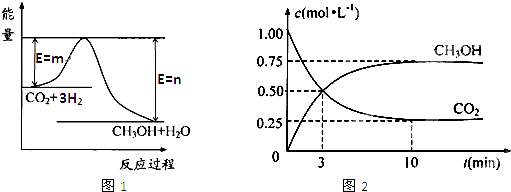
��������ЧӦ����Դ��ȱ�����⣬��ν��ʹ����е�CO2���������Կ������ã������˸������ձ����ӣ�Ŀǰ��ҵ����һ�ַ�������CO2����ȼ�ϼ״���һ�������·�����Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g������ͼ1��ʾ�÷�Ӧ���й�������������λΪkJ?mol-1���ı仯��
��1�����ڸ÷�Ӧ������˵���У���ȷ����
A����H��0����S��0�� B����H��0����S��0��
C����H��0����S��0�� D����H��0����S��0��
��2���÷�Ӧƽ�ⳣ��K�ı���ʽΪ
��
��3���¶Ƚ��ͣ�ƽ�ⳣ��K
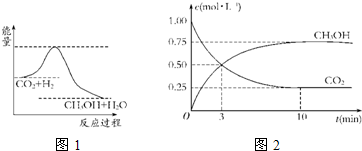
��4��Ϊ̽����Ӧԭ�����ֽ�������ʵ�飺�����Ϊ1L�ĺ����ܱ������У�����1molCO2��3molH2�����CO2��CH3OH��g����Ũ����ʱ�ʱ仯��ͼ2��ʾ���ӷ�Ӧ��ʼ��ƽ�⣬������Ũ�ȱ仯��ʾ��ƽ����Ӧ����v��H2����
��5�����д�ʩ����ʹ��4����n��CH3OH��/n��CO2���������
A�������¶ȣ�
B�����������
C����H2O��g������ϵ�з��룻
D���ٳ���1molCO2��3molH2��
E������He��g����ʹ��ϵ��ѹǿ����
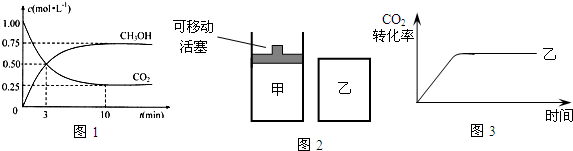
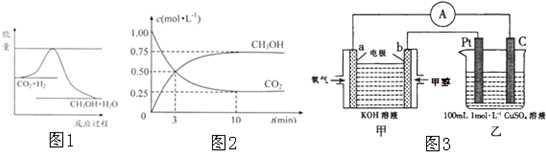
��6�����ɵļ״������Ϊȼ�ϵ�أ���ͼ3���м�װ��Ϊԭ��أ���װ��Ϊ���أ�
��b�缫�Ϸ����ĵ缫��ӦʽΪ��
����������0.1mol CH3OH�μӷ�Ӧ������װ�������ɵ������ڱ�״���µ������Ϊ

��1�����ڸ÷�Ӧ������˵���У���ȷ����
C
C
��A����H��0����S��0�� B����H��0����S��0��
C����H��0����S��0�� D����H��0����S��0��
��2���÷�Ӧƽ�ⳣ��K�ı���ʽΪ
| c(CH3OH)��c(H2O) |
| c(CO2)��c3(H2) |
| c(CH3OH)��c(H2O) |
| c(CO2)��c3(H2) |
��3���¶Ƚ��ͣ�ƽ�ⳣ��K
����
����
������������䡱��С��������4��Ϊ̽����Ӧԭ�����ֽ�������ʵ�飺�����Ϊ1L�ĺ����ܱ������У�����1molCO2��3molH2�����CO2��CH3OH��g����Ũ����ʱ�ʱ仯��ͼ2��ʾ���ӷ�Ӧ��ʼ��ƽ�⣬������Ũ�ȱ仯��ʾ��ƽ����Ӧ����v��H2����
0.225
0.225
mol?L-1?min-1����5�����д�ʩ����ʹ��4����n��CH3OH��/n��CO2���������
CD
CD
��A�������¶ȣ�
B�����������
C����H2O��g������ϵ�з��룻
D���ٳ���1molCO2��3molH2��
E������He��g����ʹ��ϵ��ѹǿ����
��6�����ɵļ״������Ϊȼ�ϵ�أ���ͼ3���м�װ��Ϊԭ��أ���װ��Ϊ���أ�
��b�缫�Ϸ����ĵ缫��ӦʽΪ��
CH3OH-6e-+8OH-=CO32-+6H2O
CH3OH-6e-+8OH-=CO32-+6H2O
������������0.1mol CH3OH�μӷ�Ӧ������װ�������ɵ������ڱ�״���µ������Ϊ
7.84
7.84
L����������1�����ݷ�Ӧ�����������������Դ�Сȷ���ʱ䣬���������������Զ���ȷ���ر䣻
��2��ƽ�ⳣ��K=
��
��3�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ���
��4������ͼ�����״���ƽ����Ӧ���ʣ��ٸ���ͬһ���淴Ӧͬһʱ����ڣ������ʵķ�Ӧ����֮�ȵ����������֮�ȼ��������ķ�Ӧ���ʣ�
��5��n��CH3OH��/n��CO2��������ƽ��������Ӧ�����ƶ���������������Ի�ѧƽ���Ӱ�������
��6���ټ״�ȼ�ϵ���У��״���ʧ���ӷ���������Ӧ����ͨ��״��ĵ缫Ϊ������
�ڼ״�ʧ���ӵ����ʵ���=0.1mol��[4-��-2��]=0.6mol��
��װ�������������������ӷŵ�����������������ͭ������ȫ����ʱ�õ��ӵ����ʵ���=1mol/L��0.1L��2=0.2mol��0.6mol�����������ϻ����������ɣ�����ת�Ƶ����غ������װ������������������
��2��ƽ�ⳣ��K=
| c(CH3OH)��c(H2O) |
| c(CO2)��c3(H2) |
��3�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ���
��4������ͼ�����״���ƽ����Ӧ���ʣ��ٸ���ͬһ���淴Ӧͬһʱ����ڣ������ʵķ�Ӧ����֮�ȵ����������֮�ȼ��������ķ�Ӧ���ʣ�
��5��n��CH3OH��/n��CO2��������ƽ��������Ӧ�����ƶ���������������Ի�ѧƽ���Ӱ�������
��6���ټ״�ȼ�ϵ���У��״���ʧ���ӷ���������Ӧ����ͨ��״��ĵ缫Ϊ������
�ڼ״�ʧ���ӵ����ʵ���=0.1mol��[4-��-2��]=0.6mol��
��װ�������������������ӷŵ�����������������ͭ������ȫ����ʱ�õ��ӵ����ʵ���=1mol/L��0.1L��2=0.2mol��0.6mol�����������ϻ����������ɣ�����ת�Ƶ����غ������װ������������������
����⣺��1������ͼ��֪����Ӧ����������������������������÷�Ӧ�Ƿ��ȷ�Ӧ�����ԡ�H��0�����ݷ���ʽ֪���÷�Ӧ�з�Ӧǰ��������������٣����ؼ�С�����ԡ�S��0����ѡC��
��2��ƽ�ⳣ��K=
���ʴ�Ϊ��
��
��3���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�����ƶ�����Ӧ��Ũ�ȼ�С��������Ũ����������ƽ�ⳣ�����ʴ�Ϊ������
��4������ͼ�����v��CH3OH��=
=0.075mol/��L��min����ͬһ���淴Ӧͬһʱ����ڣ������ʵķ�Ӧ����֮�ȵ����������֮�ȣ�����v��H2��=3v��CH3OH��=0.225 mol/��L��min����
�ʴ�Ϊ��0.225��
��5��n��CH3OH��/n��CO2��������ƽ��������Ӧ�����ƶ���
A�������¶ȣ�ƽ�����淴Ӧ�����ƶ�����n��CH3OH��/n��CO2����С���ʴ���
B�����������ƽ�ⲻһ��������n��CH3OH��/n��CO2�����䣬�ʴ���
C����H2O��g������ϵ�з��룬ƽ��������Ӧ�����ƶ�����n��CH3OH��/n��CO2��������ȷ��
D���ٳ���1molCO2��3molH2��ƽ��������Ӧ�����ƶ������൱������ѹǿ���ٽ�ƽ��������Ӧ�����ƶ������Զ�����̼��ת������������n��CH3OH��/n��CO2��������ȷ��
E������He��g����ʹ��ϵ��ѹǿ����������ʵ�Ũ�Ȳ��䣬����ƽ�ⲻһ������n��CH3OH��/n��CO2�����䣬�ʴ���
��ѡCD��
��6���ټ״�ȼ�ϵ���У��״���ʧ���ӷ���������Ӧ����ͨ��״��ĵ缫Ϊ�������缫��ӦʽΪ��CH3OH-6e-+8OH-=CO32-+6H2O��
�ʴ�Ϊ��CH3OH-6e-+8OH-=CO32-+6H2O��
�ڼ״�ʧ���ӵ����ʵ���=0.1mol��[4-��-2��]=0.6mol��
��װ�������������������ӷŵ�����������������·��ת�Ƶ�����ȣ����������������������������=
��22.4L/mol=3.36L��
������ͭ������ȫ����ʱ�õ��ӵ����ʵ���=1mol/L��0.1L��2=0.2mol��0.6mol�����������ϻ����������ɣ��������������=
��22.4L/mol=4.48L��
�����ҳ��������������=3.36L+4.48L=7.84L��
�ʴ�Ϊ��7.84��
��2��ƽ�ⳣ��K=
| c(CH3OH)��c(H2O) |
| c(CO2)��c3(H2) |
| c(CH3OH)��c(H2O) |
| c(CO2)��c3(H2) |
��3���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�����ƶ�����Ӧ��Ũ�ȼ�С��������Ũ����������ƽ�ⳣ�����ʴ�Ϊ������
��4������ͼ�����v��CH3OH��=
| 0.75mol/L |
| 10min |
�ʴ�Ϊ��0.225��
��5��n��CH3OH��/n��CO2��������ƽ��������Ӧ�����ƶ���
A�������¶ȣ�ƽ�����淴Ӧ�����ƶ�����n��CH3OH��/n��CO2����С���ʴ���
B�����������ƽ�ⲻһ��������n��CH3OH��/n��CO2�����䣬�ʴ���
C����H2O��g������ϵ�з��룬ƽ��������Ӧ�����ƶ�����n��CH3OH��/n��CO2��������ȷ��
D���ٳ���1molCO2��3molH2��ƽ��������Ӧ�����ƶ������൱������ѹǿ���ٽ�ƽ��������Ӧ�����ƶ������Զ�����̼��ת������������n��CH3OH��/n��CO2��������ȷ��
E������He��g����ʹ��ϵ��ѹǿ����������ʵ�Ũ�Ȳ��䣬����ƽ�ⲻһ������n��CH3OH��/n��CO2�����䣬�ʴ���
��ѡCD��
��6���ټ״�ȼ�ϵ���У��״���ʧ���ӷ���������Ӧ����ͨ��״��ĵ缫Ϊ�������缫��ӦʽΪ��CH3OH-6e-+8OH-=CO32-+6H2O��
�ʴ�Ϊ��CH3OH-6e-+8OH-=CO32-+6H2O��
�ڼ״�ʧ���ӵ����ʵ���=0.1mol��[4-��-2��]=0.6mol��
��װ�������������������ӷŵ�����������������·��ת�Ƶ�����ȣ����������������������������=
| 0.6mol |
| 4 |
������ͭ������ȫ����ʱ�õ��ӵ����ʵ���=1mol/L��0.1L��2=0.2mol��0.6mol�����������ϻ����������ɣ��������������=
| 0.6mol-0.2mol |
| 2 |
�����ҳ��������������=3.36L+4.48L=7.84L��
�ʴ�Ϊ��7.84��
���������⿼����ԭ��غ͵���ԭ������ѧƽ���ƶ�ԭ����֪ʶ�㣬������������Ի�ѧƽ���Ӱ�졢ԭ��غ͵���ԭ�����������ע�⣨6����װ�������ϲ�������ͭ���������������ȸ���ת�Ƶ������ȷ�����������������ʣ��������´���Ϊ�״��㣮

��ϰ��ϵ�д�
�����Ŀ
 ������CO2����ȼ�ϼ״���һ�������·�����Ӧ��CO2��g��+3H2��g��
������CO2����ȼ�ϼ״���һ�������·�����Ӧ��CO2��g��+3H2��g�� CH3OH��g��+H2O��g����������ͼ��ʾ�÷�Ӧ���й�������������λΪkJ?mol-1���ı仯��
CH3OH��g��+H2O��g����������ͼ��ʾ�÷�Ӧ���й�������������λΪkJ?mol-1���ı仯��