摘要:9.用0.01mol·L-1H2SO4溶液完全中和pH=11的下列溶液各50mL.需H2SO4溶液体积最大的是( ) A.氢氧化钡 B.氨水 C.氢氧化钾 D.氢氧化钙
网址:http://m.1010jiajiao.com/timu3_id_363024[举报]
(2008?平顶山模拟)使用酸碱中和滴定的方法,用0.01mol/L盐酸滴定锥形瓶中未知浓度的NaOH溶液,下列操作能够使测定结果偏高的是( )
①用量筒量取浓盐酸配制0.01mol/L稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸
②配制稀盐酸定容时,俯视容量瓶刻度线
③滴定结束时,读数后发现滴定管下端尖嘴处悬挂有一滴液滴
④滴定过程中用少量蒸馏水将锥形瓶内避粘附的盐酸冲下.
①用量筒量取浓盐酸配制0.01mol/L稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸
②配制稀盐酸定容时,俯视容量瓶刻度线
③滴定结束时,读数后发现滴定管下端尖嘴处悬挂有一滴液滴
④滴定过程中用少量蒸馏水将锥形瓶内避粘附的盐酸冲下.
查看习题详情和答案>>
目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境.这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应.某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验.
[实验I]硫的质量确定:
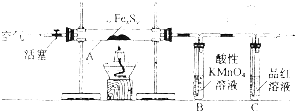
按图连接装置,检查好装置的气密性后,在硬质玻璃管A中放入1.0g铁硫簇结构(含有部分不反应的杂质),在试管B中加入50mL 0.1mol?L-1的酸性KMnO4溶液,在试管C中加入品红溶液.通入空气并加热,发现固体逐渐转变为红棕色.待固体完全转化后将B中溶液转移至250mL容量瓶,洗涤试管B后定容.取25.00mL该溶液用0.01mol?L-1的草酸(H2C2O4)进行测定剩余KMnO4溶被浓度的滴定.记录数据如下:
相关反应:①2MnO4+2H2O+5SO2=2Mn2++5SO42-+4H+②2MnO4+6H++5H2C2O4=2Mn2++10CO2↑+8H2O
[实验Ⅱ]铁的质量确定:
将实验I硬质玻璃管A中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经充分灼烧得0.6g固体.
试回答下列问题:
(1)检查“实验I”中装置气密性的方法是 .
(2)滴定终点的判断方法是 .
(3)试管C中品红溶液的作用是 .有同学提出,撤去C装置,对实验没有影响,你的看法是 (选填“同意”或“不同意”),理由是 .
(4)根据实验I和实验II中的数据可确定该铁硫簇结构的化学式为 .
[问题探究]滴定过程中发现,细心的小明发现该KMnO4颜色褪去的速率较平常滴定时要快的多.为研究快的原因.甲同学继续进行了下列实验,实验数据如下表:
(5)分析上进数据,滴定过程中反应速率较快的一种可能原因是 .
查看习题详情和答案>>
[实验I]硫的质量确定:

按图连接装置,检查好装置的气密性后,在硬质玻璃管A中放入1.0g铁硫簇结构(含有部分不反应的杂质),在试管B中加入50mL 0.1mol?L-1的酸性KMnO4溶液,在试管C中加入品红溶液.通入空气并加热,发现固体逐渐转变为红棕色.待固体完全转化后将B中溶液转移至250mL容量瓶,洗涤试管B后定容.取25.00mL该溶液用0.01mol?L-1的草酸(H2C2O4)进行测定剩余KMnO4溶被浓度的滴定.记录数据如下:
| 滴定次数 | 待测溶液体积/mL | 草酸溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
[实验Ⅱ]铁的质量确定:
将实验I硬质玻璃管A中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经充分灼烧得0.6g固体.
试回答下列问题:
(1)检查“实验I”中装置气密性的方法是
(2)滴定终点的判断方法是
(3)试管C中品红溶液的作用是
(4)根据实验I和实验II中的数据可确定该铁硫簇结构的化学式为
[问题探究]滴定过程中发现,细心的小明发现该KMnO4颜色褪去的速率较平常滴定时要快的多.为研究快的原因.甲同学继续进行了下列实验,实验数据如下表:
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0 (另加少量可溶于水MnSO4粉末) |
2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
用0.01mol/L的盐酸溶液滴定未知浓度的氢氧化钠实验操作步骤如下:
(1)检查滴定管活塞是否
(2)洗涤用
(3)洗涤用盐酸标准溶液润洗
(4)装液酸式、碱式滴定管分别装盐酸、氢氧化钠至0刻度上方
(5)赶走气泡使液面处于
(6)滴定用碱式滴定管移
(7)计算:重复滴定
.
查看习题详情和答案>>
(1)检查滴定管活塞是否
转动
转动
,滴定管是否漏水
漏水
.(2)洗涤用
蒸馏水
蒸馏水
将滴定管、锥形瓶洗涤干净.(3)洗涤用盐酸标准溶液润洗
酸
酸
式滴定管2-3
2-3
次,用氢氧化钠润洗碱式
碱式
滴定管2-3
2-3
次(4)装液酸式、碱式滴定管分别装盐酸、氢氧化钠至0刻度上方
2-3
2-3
厘米处.(5)赶走气泡使液面处于
0
0
刻度或0
0
刻度以下某一刻度记录读数.(6)滴定用碱式滴定管移
20
20
毫升待测液于锥形瓶中,滴入2-3
2-3
滴酚酞试液.用左
左
手控制活塞,右
右
手不断旋转震荡锥形瓶,眼睛注视锥形瓶中 溶液颜色变化
锥形瓶中 溶液颜色变化
,当溶液至无色且30
30
秒不再恢复红色,记下刻度.(7)计算:重复滴定
2-3
2-3
次,取其平均值,按下式计算C(OH-)=| c(标准)×V(标准) |
| V(待测) |
| c(标准)×V(标准) |
| V(待测) |
Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放热,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:
①称取过氧化钠固体2.00g;
②把这些过氧化钠固体放入气密性良好的气体发生装置中;
③向过氧化钠中滴加水,用某一量筒排水集气,量筒内液面在110mL处恰好与水槽内液面相平;
④将烧瓶中的液体转移到250mL的容量瓶中,然后加入蒸馏水,定容,使液面恰好与刻度相切;
⑤用移液管移取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO4溶液去滴定,至终点时用去了24.20mLKMnO4溶液(此时锰全部以Mn2+存在)
(1)有500mL、250mL、150mL的量筒备用,应选用量程为 的量筒,理由是 ;
(2)有酸式和碱式两种滴定管备用,该实验应选用 ,理由是 ;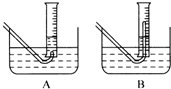
(3)在步骤③测量气体体积时,必须待试管和量筒内的气体都冷却到室温时进行,应选用右图装置中 ,理由是 ;此时量筒内的液面高于水槽中液面,立即读数会使Na2O2的纯度 (填“偏高”“偏低”或“不变”);应进行的操作是 ;
(4)在步骤⑤中滴定达到终点时,溶液的颜色变化是 ;
(5)该过氧化钠的纯度为 (实验中得到的气体体积均看作为标准状况下).
查看习题详情和答案>>
①称取过氧化钠固体2.00g;
②把这些过氧化钠固体放入气密性良好的气体发生装置中;
③向过氧化钠中滴加水,用某一量筒排水集气,量筒内液面在110mL处恰好与水槽内液面相平;
④将烧瓶中的液体转移到250mL的容量瓶中,然后加入蒸馏水,定容,使液面恰好与刻度相切;
⑤用移液管移取25.00mL容量瓶中的液体,放入锥形瓶中,用过量的稀硫酸酸化,然后用0.01mol/L的KMnO4溶液去滴定,至终点时用去了24.20mLKMnO4溶液(此时锰全部以Mn2+存在)
(1)有500mL、250mL、150mL的量筒备用,应选用量程为
(2)有酸式和碱式两种滴定管备用,该实验应选用

(3)在步骤③测量气体体积时,必须待试管和量筒内的气体都冷却到室温时进行,应选用右图装置中
(4)在步骤⑤中滴定达到终点时,溶液的颜色变化是
(5)该过氧化钠的纯度为
