摘要:2.加入还原剂可实现的变化是( ) A.CO32- → CO2 B.H2SO4 → SO2 C.Zn →Zn2+ D.C2H5OH→CH3CHO
网址:http://m.1010jiajiao.com/timu3_id_363017[举报]
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.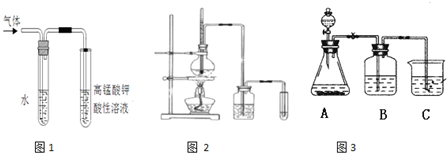
反应类型
(2)写出溴乙烷在NaOH乙醇溶液中的反应方程式
图2是实验室制乙烯并检验其性质的装置图,请回答:
(1)写出圆底烧瓶中反应的方程式
(2)烧瓶中混合液逐渐变黑,并产生某些无机杂质气体,写出产生杂质气体的化学方程式:
(3)为了检验乙烯的生成,试管中应盛放
(4)洗瓶中盛放的试剂为
某学习小组同学为了确定盐酸、苯酚、碳酸的酸性强弱,设计了如图3所示的装置图进行实验:
(1)锥形瓶内装某可溶性盐,写出A中反应的离子方程式:
(2)C中的现象为
(3)B中的试剂为
查看习题详情和答案>>

反应类型
取代
取代
.某同学取少量溴乙烷与NaOH水溶液反应后的混合溶液,向其中滴加AgNO3 溶液,加热,产生少量沉淀.该同学由此得出溴乙烷与NaOH水溶液反应,生成了溴化钠,你认为是否合理,原因:不合理没有用硝酸中和氢氧化钠溶液
不合理没有用硝酸中和氢氧化钠溶液
.(2)写出溴乙烷在NaOH乙醇溶液中的反应方程式
CH2BrCH3+NaOH
CH2=CH2↑+H2O+NaBr
| 醇 |
| 加热 |
CH2BrCH3+NaOH
CH2=CH2↑+H2O+NaBr
反应类型| 醇 |
| 加热 |
消去反应
消去反应
.反应中生成的气体可以用图1所示装置检验,现象是溶液褪色
溶液褪色
,水的作用是吸收乙醇
吸收乙醇
.除高锰酸钾酸性溶液外,还可以用溴的四氯化碳溶液
溴的四氯化碳溶液
检验生成的气体,此时还有必要将气体先通入水中吗?没有
没有
(填“有”或“没有”)图2是实验室制乙烯并检验其性质的装置图,请回答:
(1)写出圆底烧瓶中反应的方程式
CH3CH2OH
CH2=CH2↑+H2O
| 浓H2SO4 |
| 170℃ |
CH3CH2OH
CH2=CH2↑+H2O
,反应类型| 浓H2SO4 |
| 170℃ |
消去反应
消去反应
;(2)烧瓶中混合液逐渐变黑,并产生某些无机杂质气体,写出产生杂质气体的化学方程式:
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
;
| ||
(3)为了检验乙烯的生成,试管中应盛放
高锰酸钾溶液(或溴的四氯化碳溶液)
高锰酸钾溶液(或溴的四氯化碳溶液)
,现象为溶液褪色
溶液褪色
;(4)洗瓶中盛放的试剂为
氢氧化钠溶液
氢氧化钠溶液
,作用吸收SO2CO2
吸收SO2CO2
某学习小组同学为了确定盐酸、苯酚、碳酸的酸性强弱,设计了如图3所示的装置图进行实验:
(1)锥形瓶内装某可溶性盐,写出A中反应的离子方程式:
CO32-+2H+=H2O+CO2↑
CO32-+2H+=H2O+CO2↑
;(2)C中的现象为
白色浑浊
白色浑浊
,写出C中反应的化学方程式:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,
C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,
(3)B中的试剂为
饱和碳酸氢钠溶液
饱和碳酸氢钠溶液
,作用吸收CO2中的HCl
吸收CO2中的HCl
.最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇.“绿色自由”构想技术流程如下:
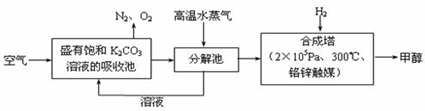
(1)在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式
(2)①上述合成反应具有一定的可逆性,从平衡移动原理分析,低温有利于原料气的转化,而实际生产中采用300°C的温度,其原因是
②“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括
③下列措施中能使n(CH3OH)/n(CO2)增大的是
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH2
(3)甲醇可制作燃料电池.写出以氢氧化钾为电解质的甲醇燃料电池负极反应式
(4)常温下,0.1mol/L KHCO3溶液的pH大于8,则溶液中各种离子浓度由大到小的顺序为:
查看习题详情和答案>>

(1)在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.47kJ?mol-1
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.47kJ?mol-1
.(2)①上述合成反应具有一定的可逆性,从平衡移动原理分析,低温有利于原料气的转化,而实际生产中采用300°C的温度,其原因是
考虑到催化剂的催化活性,加快反应速率
考虑到催化剂的催化活性,加快反应速率
.②“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括
高温水蒸气
高温水蒸气
.③下列措施中能使n(CH3OH)/n(CO2)增大的是
CD
CD
.A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH2
(3)甲醇可制作燃料电池.写出以氢氧化钾为电解质的甲醇燃料电池负极反应式
CH3OH+8OH?-6e-═CO32-+6H2O
CH3OH+8OH?-6e-═CO32-+6H2O
.当电子转移的物质的量为1.2mol
1.2mol
时,参加反应的氧气的体积是6.72L(标准状况下).(4)常温下,0.1mol/L KHCO3溶液的pH大于8,则溶液中各种离子浓度由大到小的顺序为:
c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
.(2013?闸北区二模)氯气是一种重要的化工原料.某学习小组在实验室中利用如图所示装置制取氯气并探究其性质.
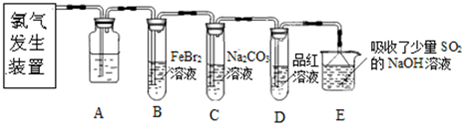
(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶和导管外还需用到的玻璃仪器有
(2)装置A中盛有的试剂是
(3)若D中品红溶液褪色,则B装置中发生反应的离子方程式是
(4)证明FeBr2与Cl2发生了氧化还原反应的实验方法是
某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气.经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32-和SO42-,对于可能存在的其他阴离子,研究小组提出以下3种假设.假设1:只存在SO32-;假设2:只存在ClO-;假设3:既不存在SO32-,也不存在ClO-.
(5)学习小组判断同时存在SO32-和ClO-是不可能的理由是
(6)现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论.
a.3mol/L H2SO4 b.0.01mol/L KMnO4c.1mol/L BaCl2溶液
d.淀粉碘化钾溶液 e.酚酞试液
步骤一;取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B两试管中.
步骤二:向A试管中滴加少量
步骤三:向B试管中滴加少量
查看习题详情和答案>>

(1)实验室用二氧化锰和浓盐酸加热制取氯气,发生装置中除圆底烧瓶和导管外还需用到的玻璃仪器有
分液漏斗、酒精灯
分液漏斗、酒精灯
;(2)装置A中盛有的试剂是
饱和食盐水
饱和食盐水
,作用是除去氯气中的氯化氢
除去氯气中的氯化氢
.(3)若D中品红溶液褪色,则B装置中发生反应的离子方程式是
2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2
2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2
(4)证明FeBr2与Cl2发生了氧化还原反应的实验方法是
实验后,取少量B中溶液,滴加KSCN溶液;另取少量B中溶液,加入CCl4溶液萃取
实验后,取少量B中溶液,滴加KSCN溶液;另取少量B中溶液,加入CCl4溶液萃取
(填操作方法).某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气.经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO32-和SO42-,对于可能存在的其他阴离子,研究小组提出以下3种假设.假设1:只存在SO32-;假设2:只存在ClO-;假设3:既不存在SO32-,也不存在ClO-.
(5)学习小组判断同时存在SO32-和ClO-是不可能的理由是
SO32-和ClO-因发生氧化还原反应,故不能共存
SO32-和ClO-因发生氧化还原反应,故不能共存
.(6)现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论.
a.3mol/L H2SO4 b.0.01mol/L KMnO4c.1mol/L BaCl2溶液
d.淀粉碘化钾溶液 e.酚酞试液
步骤一;取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分装于A、B两试管中.
步骤二:向A试管中滴加少量
b
b
(填序号),若溶液褪色
褪色
(填现象),则假设1成立.步骤三:向B试管中滴加少量
d
d
(填序号),若溶液变蓝色
变蓝色
(填现象),则假设2成立.已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定.以下是将绿矾(FeSO4?7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图.根据下图回答:

(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因:
(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤2中铁屑过量的目的是(用离子方程式表示):
(4)步骤3中,加入(NH4)2SO4固体后,应加热到
(5)抽滤装置的仪器有:
(6)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+.为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性下用KMnO4标准液滴定的方法.
称取4.0g的摩尔盐样品,溶于水,并加入适量稀硫酸.用0.2mol/L KMnO4溶液滴定,当溶液中Fe2+ 全部被氧化时,消耗KMnO4溶液体积 10.00mL.
①请完成滴定过程中发生的离子方程式:
②本实验的指示剂
A.酚酞 B.甲基橙 C.石蕊 D.不需要
③KMnO4溶液置于
④终点颜色的变化:
⑤产品中Fe2+的质量分数为
(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为:
查看习题详情和答案>>

(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因:
CO32-+H2O HCO3-+OH-
HCO3-+OH-
 HCO3-+OH-
HCO3-+OH-CO32-+H2O HCO3-+OH-
HCO3-+OH-
. HCO3-+OH-
HCO3-+OH-(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有
AB
AB
:A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤2中铁屑过量的目的是(用离子方程式表示):
Fe+2Fe3+=3Fe2+
Fe+2Fe3+=3Fe2+
.步骤2中溶液趁热过滤的原因是防止溶液冷却时,硫酸亚铁因析出而损失
防止溶液冷却时,硫酸亚铁因析出而损失
.(4)步骤3中,加入(NH4)2SO4固体后,应加热到
溶液表面出现晶膜
溶液表面出现晶膜
时,停止加热.需经过的实验操作包括:蒸发浓缩
蒸发浓缩
、冷却结晶
冷却结晶
、减压过滤(或抽滤)等得到较为干燥
干燥
的晶体.(5)抽滤装置的仪器有:
布氏漏斗
布氏漏斗
、抽滤瓶
抽滤瓶
、安全瓶、抽气泵组成.(6)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+.为了测定摩尔盐产品中Fe2+的含量,一般采用在酸性下用KMnO4标准液滴定的方法.
称取4.0g的摩尔盐样品,溶于水,并加入适量稀硫酸.用0.2mol/L KMnO4溶液滴定,当溶液中Fe2+ 全部被氧化时,消耗KMnO4溶液体积 10.00mL.
①请完成滴定过程中发生的离子方程式:
5
5
Fe2++1
1
MnO4-+8H+
8H+
=1
1
Mn2++5
5
Fe3++4
4
H2O②本实验的指示剂
D
D
.A.酚酞 B.甲基橙 C.石蕊 D.不需要
③KMnO4溶液置于
酸式
酸式
(酸式、碱式)滴定管中④终点颜色的变化:
溶液由无(浅绿)色变为浅紫色,半分钟内不褪色,说明滴定到终点
溶液由无(浅绿)色变为浅紫色,半分钟内不褪色,说明滴定到终点
.⑤产品中Fe2+的质量分数为
14%
14%
.(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为:
a<b<c
a<b<c
.(用a,b,c回答)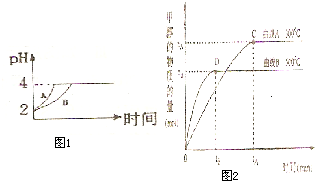 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:(1)一定温度下,在一个固定容积的密闭容器中,可逆反应 A(g)+2B(g)=4C (g)△H>0 达到平衡时,c(A)=2mol?L-1,c(B)=7mol?L-1,c(C)=4mol?L-1.试确定B的起始浓度c(B)的取值范围是
3mol/L≤c(B)≤9mol/L
3mol/L≤c(B)≤9mol/L
;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是C
C
.A.增加C的物质的量 B.加压 C.升温 D.使用催化剂
(2)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图1所示.则图中表示醋酸溶液中pH变化曲线的是
B
B
( 填“A”或“B”). 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2. 则 m1<
<
m2 ( 选填“<”、“=”、“>”)(3)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)→CH3OH(g).反应达到平衡时,平衡常数表达式K=
| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
减小
减小
(填“增大”、“减小”或“不变”).在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=| 2nB |
| 3tB |
| 2nB |
| 3tB |
(4)难溶电解质在水溶液中存在着电离平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数.例如:
Cu(OH)2(s)=Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)[c(OH-)]2=2×10-20
当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.若某CuSO4溶液里c( Cu2+)=0.02mol?L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使之大于
5
5
; 要使0.2mol?L-1的CuSO4 溶液中Cu2+沉淀较为完全 (使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH值为6
6
.(5)常温下,某纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色.则该溶液呈
碱性
碱性
性.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)向红色溶液中加入足量BaCl2溶液,如果溶液还显红色说明甲正确,红色褪去说明乙正确
向红色溶液中加入足量BaCl2溶液,如果溶液还显红色说明甲正确,红色褪去说明乙正确
.