摘要:27.2.7.85%.12%.3% (3)1.625<a<5. Fe2O3
网址:http://m.1010jiajiao.com/timu3_id_362913[举报]
 生物质资源是一种污染小的可再生能源.生物质的主要转化途径及主要产物如图.
生物质资源是一种污染小的可再生能源.生物质的主要转化途径及主要产物如图.(1)由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质.当两者1:1催化反应,其原子利用率达100%,合成的物质可能是
cd
cd
.a.汽油 b.甲醇 c.甲醛 d.乙酸
(2)甲醇是一种重要的化工原料,工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ?mol-1.
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α 1 | α 2 | α 3 |
ac
ac
.a.c1=c2 b.2Q1=Q3 c.K1=K3 d.α2+α3<100%
(3)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)

①若一体积可变的密闭容器中充入3mol H2、3mol CO、1mol CH3OCH3、1mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍.则:反应开始时:v(正)>v(逆)的理由是:
反应前后气体总质量不变,同温、同压下,达到平衡时,气体密度增大,即气体体积缩小,平衡正移
反应前后气体总质量不变,同温、同压下,达到平衡时,气体密度增大,即气体体积缩小,平衡正移
.平衡时,n(CH3OCH3)=
1.75
1.75
mol.②右图为绿色电源“二甲醚燃料电池”的工作原理示意图.b电极是
正
正
极(填“正”或“负”);a电极的反应式为(CH3)2O-12e-+3H2O=2CO2+12H+
(CH3)2O-12e-+3H2O=2CO2+12H+
.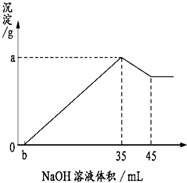 取8g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示. 试求:
取8g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示. 试求:(1)Ob段反应的离子方程式为:
H++OH-=H2O
H++OH-=H2O
(2)硫酸溶液的物质的量浓度为
1.75mol/L
1.75mol/L
.(3)若b=2.0,则铝土矿中氧化铁的质量分数是
10%
10%
. 如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得尤为紧迫.
如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得尤为紧迫.在催化剂作用下,CO2和H2可以制取甲醇和乙醇.
如:2CO2(g)+6H2(g)
| 催化剂 |
(Ⅰ) 在一定压强下,利用CO2反应制取乙醇,测得反应的实验数据如下表.分析表中数据回答下列问题:
| 温度/k CO2转化率/% n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
减小
减小
(填“增大”、“减小”、或“不变”).提高氢碳比[n(H2)/n(CO2)],平衡常数K值将不变
不变
(填“增大”、“减小”、或“不变”).(2)在600K时反应达到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有
AB
AB
(填序号).A.缩小反应器体积 B.通入CO2 C.升高温度到800K D.使用合适的催化剂
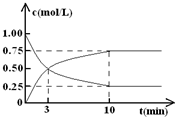
(Ⅱ)某温度下,在体积为l L的密闭容器中充入lmol CO2和4mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示.
(1)从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
0.075mol/(L?min)
0.075mol/(L?min)
;(2)氢气的平衡浓度为
1.75
1.75
mol/L.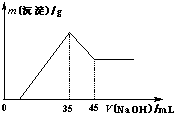 准确称取6.0g铝土矿样品(含Fe2O3),加入100mL稀硫酸中,充分反应后向滤液中加入10mol?L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如上图所示.则所用硫酸物质的量浓度为( )
准确称取6.0g铝土矿样品(含Fe2O3),加入100mL稀硫酸中,充分反应后向滤液中加入10mol?L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如上图所示.则所用硫酸物质的量浓度为( )