题目内容
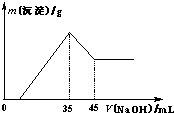
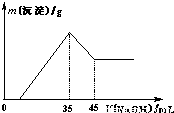
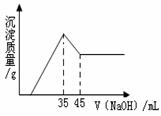
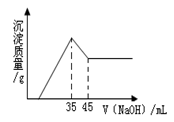
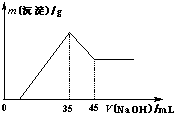 准确称取6.0g铝土矿样品(含Fe2O3),加入100mL稀硫酸中,充分反应后向滤液中加入10mol?L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如上图所示.则所用硫酸物质的量浓度为( )
准确称取6.0g铝土矿样品(含Fe2O3),加入100mL稀硫酸中,充分反应后向滤液中加入10mol?L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如上图所示.则所用硫酸物质的量浓度为( )分析:由图象可知,当加入NaOH溶液的体积为35ml时,沉淀的质量达到最大值,则此时溶液的溶质只有Na2SO4,根据Na元素守恒计算.
解答:解:当加入NaOH溶液的体积为35ml时,n(NaOH)=0.035L×10mol/L=0.35mol,
此时沉淀的质量达到最大值,则此时溶液的溶质只有Na2SO4,
根据Na元素守恒,
则有:n(H2SO4)=n(Na2SO4)=
n(NaOH)=
×0.35mol=0.175mol,
c(H2SO4)=
=1.75mol/L,
故选A.
此时沉淀的质量达到最大值,则此时溶液的溶质只有Na2SO4,
根据Na元素守恒,
则有:n(H2SO4)=n(Na2SO4)=
| 1 |
| 2 |
| 1 |
| 2 |
c(H2SO4)=
| 0.175mol |
| 0.1L |
故选A.
点评:本题考查物质的量浓度的计算,题目难度中等,本题做题时根据反应判断沉淀最大值时,溶液的溶质,结合质量守恒计算,可省去中间繁杂的计算过程.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目