摘要:24.有阳离子Al3+.Na+.Mg2+.Ba2+和阴离子CO32-.AlO2-.Cl-.OH-相互形成化合物A.B.C.D.E.试根据其主要性质填写下列分子式.并按要求写出有关离子方程式. (1)A可由明矾和氨水反应而制得.A .离子方程式 . (2)B微溶于水.可溶于稀H2 SO4.而生成无色澄清溶液.且放出气体. B .离子方程式 . (3)C的水溶液的PH值大于7.通入过量CO2气体可产生沉淀. C .离子方程式 . (4)D的水溶液的PH值小于7.与C溶液混和只产生一种沉淀. D .离子方程式 . (5)E的水溶液的PH值大于7.与D溶液混和产生白色沉淀和气体. E .离子方程式 .
网址:http://m.1010jiajiao.com/timu3_id_362903[举报]
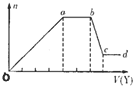 ( I)某无色稀溶液X中,可能含有下表所列离子中的某几种.
( I)某无色稀溶液X中,可能含有下表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Cu2+、Mg2+、NH4+、Na+ |
(1)若Y是盐酸,则溶液中含有的金属阳离子是
(2)若Y是NaOH溶液,则bc段反应的离子方程式为
( II)锡为第IVA族元素,锡的单质和化合物与某些物质的化学性质上有许多相似之处.已知锡元素具有如下性质:①Sn4++Sn═2Sn2+;②2Sn2++O2+4H+═2Sn4++2H2O;③2H++SnO22-?Sn(OH)2?Sn2++2OH-,试回答:
(1)锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的化学方程式:
(2)将(1)中溶液蒸干后继续加热所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是(分子式)
(3)若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2,该碱是
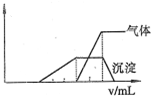 1L某混合溶液.可能含有的离子如下表: 1L某混合溶液.可能含有的离子如下表:
|
查看习题详情和答案>>
为了测定明矾[KAl(SO4)?nH2O]的纯度(其中混有少量KCl和易挥发性杂质)及n的值,按以下流程进行实验.
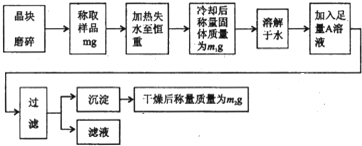
(1)晶块磨碎时使用的仪器名称是 ;
(2)判断晶体失水至恒重的方法是 ;
(3)若滤液中只含有一种阴离子(不考虑水电离的0H-)则A溶液是 (填化学式).
(4)某同学欲用实验证明明矾样品中含有的金属阳离子,请帮助该同学完成以下实验任务,填写表格的剩余部分.
(5)若加热过程中有固体飞溅出来造成损失,则会使测得的n值 (填“偏大”、“偏小”或“不影响”);通过实验,测得明矾化学式中n值为12,则明矶的纯度为 %.
查看习题详情和答案>>

(1)晶块磨碎时使用的仪器名称是
(2)判断晶体失水至恒重的方法是
(3)若滤液中只含有一种阴离子(不考虑水电离的0H-)则A溶液是
(4)某同学欲用实验证明明矾样品中含有的金属阳离子,请帮助该同学完成以下实验任务,填写表格的剩余部分.
| 阳离子 | 实验操作过程 | 实验现象 |
| K + | 用铂丝蘸取少许待测液,在酒精灯上灼烧,并透过蓝色钴玻璃观察 | |
| Al3+ | 实验操作过程: |
现象: 离子方程式: |
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.
试回答下列问题:
(1)请写出字母O代表的元素符号
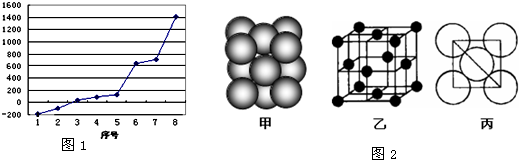
(2)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是
(4)k与l形成的化合物kl2的电子式是
 ,它在常温下呈液态,形成晶体时,属于
,它在常温下呈液态,形成晶体时,属于
(5)i单质晶体中原子的堆积方式如图2(甲)所示,其晶胞特征如图2(乙)所示,原子之间相互位置关系的平面图如图2(丙)所示.若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
一个晶胞中i原子的数目为
(用M、NA、d表示).
(6)a与d构成的阳离子和i的阳离子可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入浓氢氧化钡溶液,产生的现象有:①溶液中出现白色沉淀并伴有有刺激性气味气体放出,②沉淀逐渐增多后又逐渐减少直至最终沉淀的量不变.写出沉淀的量不变时发生反应的离子方程式
查看习题详情和答案>>
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||

试回答下列问题:
(1)请写出字母O代表的元素符号
Fe
Fe
,该元素在周期表中的位置第四周期第 VIII族
第四周期第 VIII族
.(2)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表
Si
Si
(填元素符号);其中电负性最大的是2
2
(填如图1中的序号).(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是
SiC
SiC
(填化学式),试从结构角度加以解释:因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高
因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高
.(4)k与l形成的化合物kl2的电子式是


分子
分子
晶体.(5)i单质晶体中原子的堆积方式如图2(甲)所示,其晶胞特征如图2(乙)所示,原子之间相互位置关系的平面图如图2(丙)所示.若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
一个晶胞中i原子的数目为
4
4
,该晶体的密度_
| ||
| 8NAd3 |
| ||
| 8NAd3 |
(6)a与d构成的阳离子和i的阳离子可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入浓氢氧化钡溶液,产生的现象有:①溶液中出现白色沉淀并伴有有刺激性气味气体放出,②沉淀逐渐增多后又逐渐减少直至最终沉淀的量不变.写出沉淀的量不变时发生反应的离子方程式
NH4++Al3++5OH-+2SO42-+2Ba2+=NH3↑+3H2O+AlO2-+2BaSO4↓
NH4++Al3++5OH-+2SO42-+2Ba2+=NH3↑+3H2O+AlO2-+2BaSO4↓
. (1)某混合溶液中,可能含有的离子如下表:
(1)某混合溶液中,可能含有的离子如下表:| 可能大量含有的阳离子 | H+ NH4+ Al3+ K+ Mg2+ |
| 可能大量含有的阴离子 | Cl- Br- I- CO32- AlO2- |
H+、NH4+、Al3+
H+、NH4+、Al3+
,不能确定是否含有的阳离子有K+
K+
,要确定其存在可补充做的实验是
焰色反应
焰色反应
,肯定不存在的阴离子有CO3 2-、AlO2-
CO3 2-、AlO2-
.(2)某溶液中含有Na+、Cl-、CO3 2-、SO42-,要求只取一次溶液先后检验出CO3 2-、SO4 2-、Cl-,请你选择适当的物质帮助小明同学完成下列实验设计:
取试剂,先向其中加过量
HNO3
HNO3
,确定CO3 2- 存在;再向其中加过量Ba(NO3)2溶液
Ba(NO3)2溶液
,确定SO42-存在;最后静置,在上层清液中加适量AgNO3溶液,确定Cl-存在.