题目内容
 (1)某混合溶液中,可能含有的离子如下表:
(1)某混合溶液中,可能含有的离子如下表:| 可能大量含有的阳离子 | H+ NH4+ Al3+ K+ Mg2+ |
| 可能大量含有的阴离子 | Cl- Br- I- CO32- AlO2- |
H+、NH4+、Al3+
H+、NH4+、Al3+
,不能确定是否含有的阳离子有K+
K+
,要确定其存在可补充做的实验是
焰色反应
焰色反应
,肯定不存在的阴离子有CO3 2-、AlO2-
CO3 2-、AlO2-
.(2)某溶液中含有Na+、Cl-、CO3 2-、SO42-,要求只取一次溶液先后检验出CO3 2-、SO4 2-、Cl-,请你选择适当的物质帮助小明同学完成下列实验设计:
取试剂,先向其中加过量
HNO3
HNO3
,确定CO3 2- 存在;再向其中加过量Ba(NO3)2溶液
Ba(NO3)2溶液
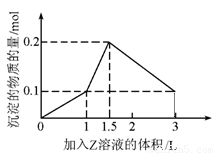
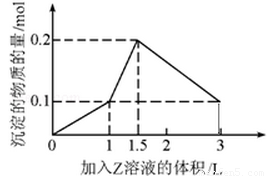
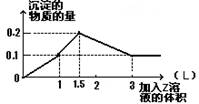
,确定SO42-存在;最后静置,在上层清液中加适量AgNO3溶液,确定Cl-存在.分析:(1)根据表中离子和图象进行分析,一开始无沉淀,溶液中一定含有H+,能够与氢离子反应离子不能存在;加NaOH有气体放出,则推断溶液中一定含有NH4+,沉淀最后完全消失,则溶液中只含有Al3+,据此进行推断;
(2)要求只取一次溶液先后检验出CO3 2-、SO4 2-、Cl-,应该先检验碳酸根离子,然后检验硫酸根离子,最后检验氯离子,注意HNO3不能改用HCl、H2SO4,Ba(NO3)2也不能改用BaCl2,避免引进干扰离子.
(2)要求只取一次溶液先后检验出CO3 2-、SO4 2-、Cl-,应该先检验碳酸根离子,然后检验硫酸根离子,最后检验氯离子,注意HNO3不能改用HCl、H2SO4,Ba(NO3)2也不能改用BaCl2,避免引进干扰离子.
解答:解:(1)根据图象,一开始无沉淀,推断溶液中一定含有H+,加NaOH有气体放出,则推断溶液中一定含有NH4+,沉淀最后完全消失,则溶液中只含有Al3+,而不含有Mg2+,K+不能确定,若要确定K+,可通过焰色反应确定,因为溶液中含有H+,所以一定不含有CO3 2-、AlO2-,
所以溶液中确定含有的阳离子有:H+、NH4+、Al3+;K+;不能确定的离子为:K+;肯定不存在的阴离子有:CO3 2-、AlO2-,
故答案为:H+、NH4+、Al3+;K+;焰色反应;CO3 2-、AlO2-;
(2)利用HNO3确定CO3 2- 的存在,利用Ba(NO3)2溶液,确定SO4 2- 的存在,利用AgNO3溶液确定Cl-的存在,
故答案为:HNO3;Ba(NO3)2溶液.
所以溶液中确定含有的阳离子有:H+、NH4+、Al3+;K+;不能确定的离子为:K+;肯定不存在的阴离子有:CO3 2-、AlO2-,
故答案为:H+、NH4+、Al3+;K+;焰色反应;CO3 2-、AlO2-;
(2)利用HNO3确定CO3 2- 的存在,利用Ba(NO3)2溶液,确定SO4 2- 的存在,利用AgNO3溶液确定Cl-的存在,
故答案为:HNO3;Ba(NO3)2溶液.
点评:本题考查了常见离子的检验方法,题目难度不大,充分考查了学生的分析、理解能力,要求熟练掌握常见离子的检验方法,能够根据反应现象推断存在离子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1 L某混合溶液中,溶质X、Y浓度都为0.1mol·L—1,向混合溶液中滴加0.1 mol·L—1某溶液Z,所得沉淀的物质的量如图所示,则X、Y、Z分别是( )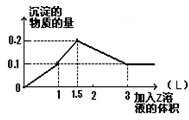
| A.氯化铝、氯化镁、氢氧化钠 | B.偏铝酸钠、氢氧化钡、硫酸 |
| C.氯化铝、氯化铁、氢氧化钠 | D.偏铝酸钠、氯化钡、硫酸 |